- PATOLOGÍA / SÍNTOMAS:
- Cáncer de uretra
- Cáncer de pene
- Cáncer de testículo
- Cáncer de vejiga
- Cáncer de próstata
- Cáncer de riñón
- Cáncer de vía urinaria superior
- Tumores benignos de la glándula suprarrenal
- Tumor maligno de la glándula suprarrenal
- Patología del uraco
- TRATAMIENTOS:
- CÁNCER DE URETRA.
- CÁNCER DE PENE.
- CÁNCER DE TESTÍCULO.
- CÁNCER DE VEJIGA.
- CÁNCER DE PRÓSTATA.
- CÁNCER DE RIÑON.
- CÁNCER DE VÍA URINARIA SUPERIOR.
- TUMORES BENIGNOS DE LAS GLÁNDULAS SUPRARRENALES.
- TUMOR MALIGNO DE LAS GLÁNDULAS SUPRARRENALES (CARCINOMA ADRENAL).
- PATOLOGÍA DEL URACO.
Cáncer de uretra
El cáncer de uretra es una enfermedad que consiste en la formación de células cancerígenas o malignas en los tejidos que comprenden la uretra, el tubo que transporta la orina desde la vejiga hasta el exterior del organismo. El tamaño de ésta varía según el sexo, en los hombres tiene un tamaño mayor que en las mujeres.
Este tipo de cáncer, es poco frecuente en la población y se dan más casos en hombres.
Etiología
Las causas para sufrir cáncer de uretra no están claras. Hay personas que tienen más factores de riesgo para padecer esta enfermedad, aunque esto no significa que la vaya a contraer. Los factores que pueden incrementar las posibilidades son:
- Tener antecedentes familiares con esta patología.
- Tener alguna afección que afecte a la uretra, ocasionando inflamación crónica. Las más importantes son: infecciones de transmisión sexual, como el virus del papiloma humano (VPH) y las infecciones de orina recurrentes.
- Tener antecedentes de cáncer vesical, ya que pueden aparecer implantes en la uretra durante la evolución de esta enfermedad.
Síntomas
Los signos de esta enfermedad no se suelen mostrar en los primeros estadíos. Entre los más frecuentes encontramos:
- Dificultad para orinar.
- Ganas frecuentes de orinar, especialmente por la noche.
- Flujo al orinar débil o interrumpido, unido muchas veces a la dificultad de vaciar por completo la vejiga.
- Incontinencia o incapacidad de controlar la orina en la vejiga.
- Secreción proveniente de la uretra.
- Presencia de sangre en la orina.
- Engrosamiento del pene en los hombres o la presencia de un bulto en las mujeres.
Subtipos
Las variantes de cáncer de uretra dependen de los tejidos que revisten este conducto y de los tipos de células que lo componen. La patología se puede diseminar y metastatizar hacia tejidos próximos o a los ganglios linfáticos. Los subtipos conocidos del cáncer uretral son:
- El carcinoma de células escamosas es el tipo más común de cáncer de uretra.
- El carcinoma de células de transición se forma en el área cercana a la abertura uretral en las mujeres y en la parte de la uretra que pasa a través de la próstata en los hombres.
- El adenocarcinoma se forma en las glándulas que rodean la uretra en los hombres y en las mujeres.
Según la localización del tumor, podemos diferenciar entre:
- Cáncer de uretra distal: en la zona más cercana al exterior del organismo.
- Cáncer de uretra proximal: localizado en la parte más próxima a la vejiga.
Diagnóstico
En el diagnóstico del cáncer de uretra se emplean múltiples herramientas, ya que se debe determinar no sólo la presencia de implantes tumorales en el órgano, sino también la posibilidad de que se haya extendido a otras partes del cuerpo. En el diagnóstico se recaba información por medio de:
- Examen físico y antecedentes de salud: examen del cuerpo para revisar el estado general de salud e identificar cualquier signo de enfermedad, como masas o cualquier otra cosa que parezca anormal. También se toman datos sobre los hábitos de salud, los antecedentes de enfermedades y los tratamientos anteriores.
- Examen pélvico: examen de la vagina, el cuello uterino, el útero, las trompas de Falopio, los ovarios y el recto.
- Examen digital del recto: examen del recto
- Estudio citológico de la orina: prueba de laboratorio mediante la que se observa la orina al microscopio para detectar células anormales.
- Análisis de orina: prueba para analizar el color de la orina y su contenido.
- Analítica de sangres: pruebas por las que se examina una muestra de sangre para medir la cantidad de ciertas sustancias que los órganos y tejidos del cuerpo liberan en la sangre.
- Uretroscopia: procedimiento para observar el interior de la uretra y verificar la presencia de áreas anormales.
- Biopsia: extracción de células o muestras de tejidos de la uretra,.
El proceso que se utiliza para determinar si el cáncer se diseminó dentro de la uretra o a otras partes del cuerpo se llama estadificación. La información que se obtiene en el proceso de estadificación determina el estadio de la enfermedad. Es importante saber en qué estadio se encuentra la enfermedad para planificar su tratamiento.
Durante el proceso de estadificación se utilizan los siguientes procedimientos:
- Radiografía del tórax: radiografía de los órganos y los huesos dentro del tórax.
- Tomografía computarizada (TC) de la pelvis y el abdomen: procedimiento para el que se toma una serie de imágenes detalladas del interior del cuerpo desde ángulos diferentes.
- Imágenes por resonancia magnética (RM)
- Uretrografía: serie de radiografías de la uretra. Se inyecta contraste a través de la uretra hacia la vejiga.
Tratamientos
Hay diferentes tipos de tratamiento disponibles para los pacientes de cáncer de uretra.
Tratamientos:
Cirugía
La cirugía para extirpar el cáncer es el tratamiento más común del cáncer de uretra. A veces se realizan uno de los siguientes tipos de cirugía.
- Resección abierta: extracción del cáncer por medio de cirugía.
- Resección transuretral (RTU): cirugía para extirpar el cáncer mediante una herramienta especial introducida en la uretra.
- Electroresección con fulguración: cirugía para extirpar cáncer mediante una corriente eléctrica.
- Cirugía láser: procedimiento quirúrgico para el que se usa un haz de rayo láser como si fuera un bisturí para hacer cortes sin sangrado en el tejido o para extirpar o destruir el tejido.
- Disección de ganglios linfáticos: a veces se extraen los ganglios linfáticos de la pelvis y la ingle.
- Cistouretrectomía: cirugía para extraer la vejiga y la uretra.
- Cistoprostatectomía: cirugía para extraer la vejiga y la próstata.
- Exenteración pélvica anterior: cirugía para extraer la uretra, la vejiga y la vagina.
- Penectomía parcial: cirugía para extraer la parte del pene que rodea la uretra hasta donde se diseminó el cáncer.
- Penectomía radical: cirugía para extraer todo el pene.
Si se extrae la uretra, el cirujano abrirá una nueva vía para que la orina salga del cuerpo. Este procedimiento se llama derivación de la orina. El cirujano a veces usa una parte del intestino delgado para hacer un tubo a fin de que la orina pase a través de una abertura (estoma). Esto se llama ostomía o urostomía.
Una vez que el médico extirpa todo el cáncer visible al momento de la cirugía, es posible que algunos pacientes reciban quimioterapia o radioterapia después de la cirugía para eliminar cualquier célula cancerosa que quede. El tratamiento administrado después de la cirugía para disminuir el riesgo de que el cáncer vuelva se llama terapia adyuvante.
Radioterapia
La radioterapia es un tratamiento del cáncer para el que se usan rayos X de alta energía u otros tipos de radiación para destruir las células cancerosas o impedir que crezcan.
Hay dos tipos de radioterapia:
- Radioterapia externa: tipo de radioterapia para la que se usa una máquina que envía la radiación hacia el área con cáncer desde el exterior del cuerpo.
- Radioterapia interna: tipo de radioterapia para la que se usa una sustancia radiactiva sellada en agujas, semillas, alambres o catéteres que se colocan directamente dentro del cáncer o cerca de este. La radioterapia interna también se llama braquiterapia.
La forma en que se administra la radioterapia depende del tipo de cáncer y el lugar de la uretra donde se formó el cáncer. La radioterapia externa e interna se usan para tratar el cáncer de uretra.
Quimioterapia
La quimioterapia es un tratamiento del cáncer en el que se usan medicamentos para interrumpir la formación de las células cancerosas, ya sea mediante su destrucción o al impedir su multiplicación.
Según la localización del cáncer, pueden utilizarse determinados tratamientos y otros no.
Para el cáncer de uretra distal…
El tratamiento del cáncer de uretra distal es diferente para hombres y mujeres.
Para las mujeres, el tratamiento incluye los siguientes procedimientos:
- Cirugía para extirpar el tumor (resección transuretral), electroresección y fulguración o cirugía láser para tumores que no se diseminaron profundamente dentro del tejido.
- Braquiterapia (radioterapia interna) o radioterapia externa para tumores que no se diseminaron profundamente dentro del tejido.
- Cirugía para extirpar el tumor (exenteración pélvica anterior) para tumores que se diseminaron profundamente hacia el tejido. A veces, también se extirpan los ganglios linfáticos cercanos (disección de ganglios linfáticos). En ocasiones, se administra radioterapia antes de la cirugía.
Para los hombres, el tratamiento incluye los siguientes procedimientos:
- Cirugía para extirpar el tumor (resección transuretral) electroresección y fulguración o cirugía láser para tumores que no se diseminaron profundamente hacia el tejido.
- Cirugía para extirpar la parte del pene (penectomía parcial) para tumores que están cerca de la punta del pene. A veces, también se extirpan los ganglios linfáticos cercanos (disección de ganglios linfáticos).
- Cirugía para extirpar parte de la uretra para tumores que están en la uretra distal pero no están en la punta del pene, ni se diseminaron profundamente hacia el tejido. A veces, también se extirpan los ganglios linfáticos cercanos (disección de ganglios linfáticos).
- Cirugía para extirpar el pene (penectomía radical) para tumores que se diseminaron profundamente dentro del tejido. A veces, también se extirpan los ganglios linfáticos cercanos (disección de ganglios linfáticos).
- Radioterapia, con quimioterapia o sin esta.
- Quimioterapia administrada junto con radioterapia.
Para el cáncer de uretra proximal…
El tratamiento para el cáncer de uretra proximal o el cáncer de uretra que afecta toda la uretra es diferente para hombres y mujeres.
Para las mujeres, el tratamiento incluye los siguientes procedimientos:
- Radioterapia o cirugía (resección abierta, resección transuretral) para tumores que miden ¾ de pulgada o menos.
- Radioterapia seguida de cirugía (exenteración pélvica anterior con disección de ganglios linfáticos y derivación de la orina).
Para los hombres, el tratamiento incluye el siguiente procedimiento:
- Radioterapia o radioterapia y quimioterapia, seguidas de cirugía (cistoprostatectomía, penectomía, disección de ganglios linfáticos y derivación de la orina).
Para el cáncer de uretra derivado del cáncer de vejiga
El tratamiento del cáncer de uretra que se forma al mismo tiempo que el cáncer de vejiga invasivo incluye los siguientes procedimientos:
- Cirugía (cistouretrectomía para mujeres o uretrectomía y cistoprostatectomía para hombres).
Para el cáncer de uretra metastásico…
El tratamiento del cáncer de uretra que hizo metástasis (se diseminó a otras partes del cuerpo), por lo habitual es quimioterapia.
El tratamiento del cáncer de uretra recidivante incluye uno o más de los siguientes procedimientos:
- Cirugía para extirpar el tumor. A veces, también se extirpan los ganglios linfáticos cercanos (disección de ganglios linfáticos).
- Radioterapia.
Cáncer de pene
Factores de riesgo
La infección por el virus del papiloma humano (VPH) es el factor de riesgo más asociado con el cáncer de pene. Existen más de 100 serotipos, pero sólo algunos incrementan la posibilidad de aparición de cáncer en los órganos genitales.
Otros factores involucrados son:
- Edad mayor de 60 años.
- Fimosis (afección por la que el prepucio del pene no se puede mover hacia atrás sobre el glande).
- Higiene personal inadecuada.
- Consumo de productos de tabaco.
Síntomas
Los signos y síntomas que sugieren la presencia de cáncer de pene son:
- Enrojecimiento, irritación o una llaga en el pene.
- Úlceras que no curan.
- Una masa en el pene.
Diagnóstico
Se realiza lo siguiente:
- Examen físico y antecedentes: examen del cuerpo para revisar el estado general de salud e identificar cualquier signo de enfermedad en el pene, como masas o cualquier otra cosa que parezca anormal. También se toman datos sobre los hábitos de salud, los antecedentes de enfermedades y los tratamientos anteriores.
- Biopsia: extracción de células o tejidos para que un patólogo los observe al microscopio y determine si hay signos de cáncer. La muestra de tejido se extrae mediante uno de los siguientes procedimientos.
- Biopsia por incisión: extracción de una parte de una masa o de una muestra de tejido que no tiene aspecto normal.
- Biopsia por escisión: extracción completa de una masa o área de tejido que no tiene aspecto normal.
Estadificación
En el diagnóstico es importante determinar si el cáncer de pene está localizado o se ha extendido a otras regiones del cuerpo. Se utilizan diversas pruebas complementarias que ubicaran el caso dentro de un estadio clínico concreto: 0, I, II, III ó IV. Es importante saber el estadio para planificar el tratamiento.
Estadios del cáncer de pene
Los diferentes estadios son:
Estadio 0
El estadio 0 se divide en los estadios 0is y 0a.
- En el estadio 0is, se encuentran células anormales en la superficie de la piel del pene. Estas células anormales forman bultos que a veces se vuelven cancerosos y se diseminan al tejido normal cercano. El estadio 0is también se llama carcinoma in situ o neoplasia intraepitelial de pene.
- En el estadio 0a, el cáncer de células escamosas que no se disemina se encuentra en la superficie de la piel del pene o en la superficie interna del prepucio del pene. El estadio 0a también se llama carcinoma de células escamosas localizado no invasivo.
Estadio I
En el estadio I, el cáncer se formó y se diseminó al tejido que está justo debajo de la piel del pene. El cáncer no se diseminó a los vasos linfáticos, los vasos sanguíneos ni los nervios. Las células cancerosas se parecen a las células normales cuando se observan al microscopio.
Estadio II
El estadio II se divide en los estadios IIA y IIB.
En el estadio IIA, el cáncer se diseminó de la siguiente manera:
- al tejido que está justo debajo de la piel del pene. El cáncer se diseminó a los vasos linfáticos, los vasos sanguíneos o los nervios; o
- al tejido que está justo debajo de la piel del pene. Las células cancerosas se ven muy anormales o son sarcomatoides cuando se observan al microscopio; o
- al cuerpo esponjoso (tejido esponjoso eréctil del cuerpo del pene y el glande que se llena de sangre durante una erección).
En el estadio IIB, el cáncer se diseminó de la siguiente manera:
- a través de la capa de tejido conjuntivo que rodea el cuerpo cavernoso (tejido esponjoso eréctil del cuerpo del pene) y dentro del cuerpo cavernoso.
Estadio III
El estadio III se divide en los estadios IIIA y IIIB. El cáncer se encuentra en el pene.
- En el estadio IIIA, el cáncer se diseminó a 1 o 2 ganglios linfáticos de un lado de la ingle.
- En el estadio IIIB, el cáncer se diseminó a 3 o más ganglios linfáticos de un lado de la ingle, o a los ganglios linfáticos de ambos lados de la ingle.
Estadio IV
En el estadio IV, el cáncer se diseminó de la siguiente manera:
- a los tejidos cercanos al pene, como el escroto, la próstata o el pubis, y es posible que se haya diseminado a los ganglios linfáticos de la ingle o la pelvis; o
- a uno o más ganglios linfáticos de la pelvis, o el cáncer se diseminó a través de la cubierta externa de los ganglios linfáticos al tejido cercano; o
- a los ganglios linfáticos fuera de la pelvis o hasta otras partes del cuerpo, como los pulmones, el hígado o los huesos.
Tratamientos
Cirugía
La cirugía es el tratamiento más común para todos los estadios del cáncer de pene. Un médico puede extirpar el cáncer mediante una de las siguientes operaciones:
- Cirugía micrográfica de Mohs: procedimiento en el que se corta el tumor de la piel en capas delgadas. Durante la cirugía, se observan al microscopio los bordes del tumor y cada una de las capas del tumor que se extraen para determinar si hay células cancerosas. Se extirpan capas hasta que ya no se ven células cancerosas. Con este tipo de cirugía se extrae la menor cantidad posible de tejido normal y a menudo se utiliza para extraer el cáncer que está en la piel. Este procedimiento también se llama cirugía de Mohs.
- Cirugía láser: procedimiento quirúrgico para el que se usa un rayo láser como si fuera un bisturí para hacer cortes sin sangrado en el tejido o para extirpar una lesión superficial, como un tumor.
- Criocirugía: tratamiento para el que se usa un instrumento para congelar y destruir tejido anormal. Este tipo de tratamiento también se llama crioterapia.
- Circuncisión: cirugía para extraer una parte o todo el prepucio del pene.
- Escisión local amplia: Cirugía para extirpar el cáncer y algo del tejido sano que lo rodea.
- Amputación del pene: Cirugía para extirpar una parte o todo el pene. Si se extrae una parte del pene, la amputación es una penectomía parcial. Si se extrae todo el pene, es una penectomía total.
Durante la cirugía, a veces se extirpan los ganglios linfáticos de la ingle.
Después de que el médico extirpa todo el cáncer visible en el momento de la cirugía, es posible que algunos pacientes reciban quimioterapia o radioterapia para destruir cualquier célula cancerosa que quede. El tratamiento que se administra después de la cirugía para disminuir el riesgo de que el cáncer vuelva se llama terapia adyuvante.
Radioterapia
La radioterapia es un tratamiento del cáncer para el que se usan rayos X de alta energía u otros tipos de radiación para destruir células cancerosas o impedir que crezcan. Hay dos tipos de radioterapia.
- Radioterapia externa: tipo de radioterapia para la que se usa una máquina que envía la radiación hacia el cáncer desde el exterior del cuerpo.
- Radioterapia interna: tipo de radioterapia para la que se usa una sustancia radioactiva sellada en agujas, semillas, alambres o catéteres que se colocan directamente en el cáncer o cerca de este.
Quimioterapia
La quimioterapia es un tratamiento del cáncer en el que se usan medicamentos para interrumpir la formación de células cancerosas, ya sea mediante su destrucción o al impedir su multiplicación.
Medicamentos biológicos
La terapia biológica es un tratamiento en el que se usa el sistema inmunitario del paciente para combatir el cáncer. Se utilizan sustancias elaboradas por el cuerpo o producidas en un laboratorio para impulsar, dirigir o restaurar las defensas naturales del cuerpo contra el cáncer. Este tipo de tratamiento del cáncer también se llama bioterapia o inmunoterapia. La terapia biológica tópica con imiquimod a veces se usa para tratar el cáncer de pene en estadio 0.
Biopsia del ganglio centinela
La biopsia de ganglio linfático centinela es la extracción del ganglio linfático centinela durante una cirugía. El ganglio linfático centinela es el primer ganglio de un grupo de ganglios linfáticos que recibe el drenaje linfático del tumor primario. Es el primer ganglio linfático donde es probable que el cáncer del tumor primario se disemine. Se inyecta una sustancia radiactiva o un tinte azul cerca del tumor. La sustancia o el tinte fluyen a través de los conductos linfáticos hasta los ganglios linfáticos. Se extrae el primer ganglio que recibe la sustancia o el tinte.
Un patólogo observa el tejido al microscopio para detectar células cancerosas. Si no se detectan células cancerosas, quizás no se necesite extirpar más ganglios linfáticos. A veces, se encuentra un ganglio linfático centinela en más de un grupo de ganglios linfáticos. Luego de la biopsia de ganglio linfático centinela, el cirujano extirpa el cáncer.
Según cada estadio, pueden usarse ciertos tipos de tratamientos y otros no.
Estadio 0
El tratamiento para el estadio 0 incluye uno de los siguientes procedimientos:
- Microcirugía de Mohs.
- Quimioterapia tópica.
- Terapia biológica tópica con imiquimod.
- Cirugía láser.
- Criocirugía.
Estadio I
Si el cáncer se encuentra solo en el prepucio, es posible que solo se necesite un tratamiento de escisión local amplia y circuncisión.
El tratamiento para el cáncer de pene en estadio I incluye los siguientes procedimientos:
- Cirugía (penectomía parcial o total, con extracción de los ganglios linfáticos de la ingle o sin esta).
- Radioterapia externa o interna.
- Microcirugía de Mohs.
- Participación en un ensayo clínico de terapia láser.
Estadio II
El tratamiento para el cáncer de pene en estadio II incluye los siguientes procedimientos:
- Cirugía (penectomía parcial o total, con extracción de los ganglios linfáticos de la ingle o sin esta).
- Radioterapia externa o interna seguida de cirugía.
- Participación en un ensayo clínico de biopsia de ganglio linfático centinela seguida de cirugía.
- Participación en un ensayo clínico de cirugía láser.
Estadio III
El tratamiento para el cáncer de pene en estadio III incluye los siguientes procedimientos:
- Cirugía (penectomía y extracción de ganglios linfáticos de la ingle, con radioterapia o sin esta).
- Radioterapia.
- Participación en un ensayo clínico de biopsia de ganglio linfático centinela seguida de cirugía.
- Participación en un ensayo clínico de radiosensibilizadores.
- Participación en un ensayo clínico de quimioterapia, antes o después de la cirugía.
- Participación en un ensayo clínico con medicamentos nuevos, terapia biológica o nuevos tipos de cirugía.
Estadio IV
El tratamiento para el cáncer de pene en estadio IV por lo general es paliativo (para aliviar los síntomas y mejorar la calidad de vida). El tratamiento incluye los siguientes procedimientos:
- Cirugía (escisión local amplia y extracción de los ganglios linfáticos de la ingle).
- Radioterapia.
- Participación en un ensayo clínico de quimioterapia, antes o después de la cirugía.
- Participación en un ensayo clínico con medicamentos nuevos, terapia biológica o nuevos tipos de cirugía.
Cáncer de testículo
El cáncer de testículo es el tumor más frecuente en hombres entre los 15 y los 35 años. Sin embargo, tras este pico de incidencia se convierte en una rareza y, en general sólo supone el 1% del total de los tumores diagnosticados en varones. En España, el pasado 2019 se diagnosticaron aproximadamente 1.300 casos nuevos. Su frecuencia varía en los diferentes países por motivos que desconocemos.
Desde los años 90 el número de casos diagnosticados va en aumento por causas que se desconocen, aunque la mortalidad ha descendido, reflejando las mejoras en el tratamiento de estos pacientes.
Afortunadamente, la gran mayoría de los pacientes se curan, incluso en aquellos casos en los que la enfermedad se presenta inicialmente ya muy avanzada. Esto es posible fundamentalmente gracias a los esquemas de quimioterapia.
Etiología
La causa concreta del cáncer de testículo resulta desconocida, al igual que la de otros muchos tumores; pero sí se han identificado algunos factores de riesgo con una clara asociación con los tumores germinales.
El principal factor de riesgo es la criptorquidia (falta de descenso del testículo hasta el escroto durante los primeros años de vida).
Entre el 1 y el 3% de los pacientes con tumores germinales tienen historia familiar de cáncer de testículo, lo cual sugiere un componente hereditario. De la misma forma, los hermanos o los hijos de estos enfermos tienen hasta 10 veces más riesgo de desarrollar la enfermedad. Sin embargo, todavía no están bien establecidos los factores genéticos responsables.
Prevención
En términos generales no existe ninguna forma de prevenir el cáncer de testículo, porque no se conoce ningún factor de riesgo que se pueda evitar. Además, la frecuencia de la enfermedad es baja, incluso en las personas que presentan factores de riesgo. Por otra parte, sí está demostrado que la orquidopexia (intervención mediante la cual se baja y fija un testículo no descendido al escroto de forma natural) previene el desarrollo de cáncer de testículo en el subgrupo de los niños con criptorquidia.
No está recomendada la realización de exploraciones o pruebas rutinarias para diagnosticarlo de forma precoz en la población general, dado que es un tumor poco frecuente, de fácil diagnóstico en estadios iniciales y de buen pronóstico. Sin embargo, sí es importante que la población diana de esta enfermedad (varones entre 15-35 años) esté familiarizada con los signos y síntomas de alarma más comunes.
Sintomatología
La gran mayoría de los tumores germinales del varón se diagnostican porque el paciente se palpa un bulto en el testículo, que con frecuencia no duele. En los casos en los que existe dolor, suele aparecer progresivamente, aunque puede hacerlo de forma repentina si el tumor se complica con una infección (orquiepididimitis) o si sangra. En general los pacientes describen más una sensación de peso en el área genital o simplemente un aumento de tamaño del testículo.
En casos mucho más raros, estos tumores pueden ocasionar un crecimiento de las mamas en varones (ginecomastia) por el aumento de la beta-gonadotropina coriónica (β-HCG). En algunos pacientes puede existir dolor de espalda o de abdomen, causado porque los estímulos dolorosos del testículo se dirigen hacia ese lugar, o bien porque existan metástasis (extensiones del tumor de testículo a otras zonas) en ganglios linfáticos de la parte más posterior del abdomen (retroperitoneo).
Por último, en los casos en los que existen metástasis en otros órganos (por ejemplo, en el pulmón, cerebro, hueso, etc.), éstas pueden producir síntomas muy variados (falta de aire, inestabilidad, dolor, etc.), dependiendo de su localización.
Tipos histológicos
Los tipos histológicos son las distintas clases de tumores que se pueden desarrollar en un órgano. Estos tipos vienen determinados en función de las características microscópicas del tumor.
En el caso de los tumores de testículo, cuando la célula germinal crece de una forma anómala, puede seguir distintos patrones y dar lugar a dos grandes familias de tumores:
– Seminomas: estos representan aproximadamente el 50% de los tumores germinales y suelen aparecer por término medio 10 años más tarde (entorno a la cuarta década de la vida). Para que un tumor de testículo se considere seminoma, no debe estar mezclado con otros tipos de tumor. Existen dos subtipos:
- Seminoma clásico
- Seminoma atípico
– No seminomas: los tumores no seminomatosos suelen aparecer durante la tercera década de la vida. Cuando hablamos de “no seminoma” en realidad hacemos alusión a un grupo que incluye a varios posibles subtipos:
- Carcinoma embrionario
- Coriocarcinoma
- Tumor del seno endodérmico
- Teratoma
El subtipo más frecuente es el carcinoma embrionario, si bien los pacientes suelen tener tumores mixtos que mezclan en distinta proporción cualquiera de estos subtipos e incluso partes de seminoma (en este caso particular, se continúan considerando no seminomas).
Diagnóstico
Cuando se aborda un probable caso de cáncer de testículo, además de preguntar por los síntomas y explorar al paciente, se completa el estudio con las siguientes pruebas complementarias:
- Analítica general, incluyendo LDH, alfa-fetoproteína y β-hCG. Estas sustancias se denominan marcadores tumorales. Son proteínas producidas por las células del tumor y van a resultar muy útiles para el diagnóstico y/o el seguimiento de la enfermedad. La β-HCG puede estar elevada en cualquier tipo de tumor de testículo, mientras que la alfa-fetoproteína solo aumenta en los tumores no seminomatosos. La LDH (lactato deshidrogenasa) es otra proteína presente en la sangre que también se eleva en algunos pacientes con tumores de testículo, y deberá vigilarse su evolución durante el tratamiento. Sin embargo, como ocurre en otros tipos de cáncer, los marcadores tumorales no aumentan en todos los pacientes con cáncer de testículo; ni tampoco cualquier elevación de estas proteínas se corresponde inequívocamente con el hecho de tener un tumor germinal.
- Ecografía del testículo: es una prueba crucial, ya que nos permite distinguir un tumor de otras entidades benignas que también podrían ocasionar un nódulo palpable en el testículo. Si definitivamente se confirma la existencia de una tumoración, mediante ecografía se pueden observar las características de la misma (localización, tamaño, vascularización, etc.), explorar el testículo contralateral, etc.
- Tomografía axial computarizada (TAC) del tórax, abdomen y pelvis: permite estudiar el resto de órganos del cuerpo y las principales vías de drenaje linfático testicular, de manera que es imprescindible para una correcta estadificación del caso.
Además, pueden realizarse en algunos casos:
- TAC o resonancia nuclear magnética (RNM) cerebral: si se sospecha la existencia de metástasis cerebrales.
- Gammagrafía ósea: si se sospecha la existencia de metástasis óseas.
- Tomografía por emisión de positrones (PET): se utiliza en ocasiones para valorar los restos de tumor que pueden persistir tras el tratamiento quimioterápico inicial en casos de enfermedad avanzada. El PET no está indicado como procedimiento de rutina en el diagnóstico inicial de todos los casos.
Estadificación
- Estadio I: el tumor sólo afecta al testículo.
- Estadio II: el tumor se extiende a ganglios linfáticos, normalmente localizados en el retroperitoneo (la zona que se encuentra detrás del abdomen).
- Estadio III: el tumor presenta metástasis o elevación muy importante de los marcadores tumorales.
Pronóstico
Los factores pronósticos son características del tumor y del paciente que permiten estimar a priori su evolución posterior, complementando el estadio marcado por el sistema TNM.
En el cáncer de testiculo con metastasis tratado con quimioterapia existen 3 factores pronósticos de gran importancia con los que en el año 1997 se elaboró una clasificación pronóstica de enorme alcance, aún vigente, y crítica a la hora de determinar el tratamiento más adecuado para cada enfermo: La Clasificación Pronóstica del International Germ Cell Cancer Collaborative Group (IGCCCG).
Esta clasificación establece 3 categorías para los tumores no seminomatosos (pronóstico favorable, intermedio o desfavorable); y 2 para los seminomatosos (pronóstico favorable o intermedio; no existen pacientes con pronóstico desfavorable en este subtipo histológico). Los factores pronósticos son:
- Que el tumor se origine en el propio testículo (signo de buen pronóstico) o fuera de él. Un pequeño porcentaje de tumores de células germinales pueden presentarse en zonas del cuerpo distintas del testículo, sin que se encuentre tumor en el propio testículo; bien porque el tumor inicial ha desaparecido o porque realmente la enfermedad se originó fuera del testículo. Esto último puede suceder porque durante el desarrollo del embrión el testículo migra hasta su posición final en el escroto. En este trayecto pueden quedar restos de células del testículo que muy raramente ya en la edad adulta pueden dar lugar a tumores.
- La ausencia de metástasis a distancia (M1) (signo de buen pronóstico), con excepción de las metástasis de pulmón que por sí solas no indican mal pronóstico.
- El grado de elevación de los marcadores tumorales. En general, cuanto más elevados, el pronóstico es peor.
Tratamiento
Si bien los tumores germinales del testículo tienen muy buen pronóstico en manos experimentadas, hablamos de neoplasias de muy rápido crecimiento, que suponen una agresión muy importante para el organismo, y que suelen afectar a pacientes muy jóvenes. Es por ello que la principal recomendación internacional es que estos enfermos sean derivados rápidamente a centros especializados con profesionales habituados a su manejo.
Hay que tener en cuenta que, una vez curados, estos pacientes se habrán visto sometidos a tratamientos que merman su capacidad reproductiva, y que impactan en su esfera sexual y de la autoimagen, por lo que debemos prever estos detalles desde el principio, implicar a sus parejas si las hay, preservar esperma si procede, y aconsejar adecuadamente en el momento oportuno.
El tratamiento de los tumores de testículo requiere en primer lugar quitar el testículo mediante una intervención quirúrgica llamada orquiectomía. Éste es uno de los pocos tumores en los que, incluso si la enfermedad se ha extendido a otros órganos se debe quitar el tumor original. Las razones son que los tratamientos de quimioterapia llegan mal al testículo y que el examen del tumor es muy importante para determinar sus características y su tratamiento. La cirugía para quitar el testículo siempre debe realizarse a través de la ingle (vía inguinal) y no a través de la piel del escroto (vía transescrotal), ya que de lo contrario aumentan las posibilidades de contaminación del tejido sano por células del tumor.
Una vez extirpado el testículo, el tratamiento se decide en función:
- Del tipo de tumor (seminoma o no seminoma): el tratamiento de los seminomas y de los tumores no seminomatosos en estadios I y II es distinto, pero en los estadios III es relativamente similar;
- De su extensión (estadio I, II o III); y
- De su categoría pronóstica (favorable, intermedia, o desfavorable).
Aunque aquí se comentan brevemente los tratamientos más habituales.
Tratamiento de acuerdo a los diferentes estadios
- Estadio I:
Los pacientes con tumores de testículo en estadio I se curan con el tratamiento adecuado en casi el 100% de los casos. Como se ha comentado previamente, estos tumores sólo afectan al testículo, por lo que en teoría su extirpación debería ser curativa por sí misma. El problema es que en un pequeño porcentaje de los pacientes la enfermedad puede volver a aparecer. Para evitarlo, en algunos casos se puede administrar tratamiento complementario con intención preventiva (tratamiento adyuvante) que disminuye de forma muy importante el riesgo de que la enfermedad reaparezca. Los tratamientos adyuvantes (tanto quimioterapia como radioterapia) implican riesgos y pueden generar secuelas.
- Seminoma:
El 80% de los pacientes quedan curados tras la orquiectomía, pero en un 20% de los casos, la enfermedad puede volver a aparecer. Por lo tanto, en los pacientes con seminoma estadio I, las alternativas son:
– Administrar quimioterapia con 1 ó 2 ciclos de un fármaco llamado carboplatino. Este tratamiento es bien tolerado y disminuye el riesgo de recaída a un 3-4%.
– No administrar ningún tratamiento y realizar observación cuidadosa del paciente. Así se evita realizar tratamientos innecesarios a pacientes que realmente no iban a tener una recaída.
– Tratamiento con radioterapia retroperitoneal. Estos tumores son muy radiosensibles y la radioterapia es eficaz para tratarlos. Sin embargo, hoy en día esta opción terapéutica es menos empleada por las toxicidades tardías.
- No seminoma:
En los tumores no seminomatosos el 70% de los pacientes se curan solamente con cirugía, pero en el 30% restante el tumor puede volver a aparecer. Hoy en día no disponemos de factores que nos segregan bien qué pacientes van a recaer y cuáles no.
En principio, aquellos pacientes cuyo tumor invade los vasos sanguíneos o los vasos linfáticos del testículo tienen más riesgo de que la enfermedad reaparezca. En este caso podría estar más justificado tratar de forma preventiva con quimioterapia mediante la administración de dos ciclos con unos fármacos llamados bleomicina, etopósido y cisplatino (BEP). Sin embargo, con esta estrategia estaríamos sobre tratando a un porcentaje de pacientes próximo al 50% que nunca van a recaer tras ser operados.
Los pacientes cuyo tumor no invade los vasos sanguíneos o linfáticos, tienen menos riesgo de que la enfermedad reaparezca y en ellos se tiende a ser menos agresivo y en términos generales se tiende a hacer únicamente un seguimiento cuidadoso.
Otra opción es vigilar a todos los pacientes y no tratar más que a aquellos en los que la enfermedad reaparezca para evitar realizar tratamientos innecesarios, como ya comentamos anteriormente.
También en los tumores no seminomatosos, en caso de que la enfermedad reaparezca, tanto si se ha administrado quimioterapia complementaria como si no, el tratamiento se adecúa al escenario de tumor avanzado.
- Estadio II:
Los pacientes con estadio II tienen enfermedad en los ganglios del retroperitoneo. La mayoría de estos pacientes también se curan con un tratamiento adecuado.
- Seminoma: el tratamiento habitual de estos pacientes consiste en quimioterapia con 3 ciclos de BEP o cuatro ciclos de cisplatino y etopósido (EP), que consiguen un resultado equivalente. En algunos pacientes, después de estos tratamientos quedan restos de los ganglios linfáticos del retroperitoneo que no desaparecen por completo. Ante esta situación hay dos opciones en función del tamaño de la masa residual (restos del tumor). En aquellas masas residuales mayores de 3 cm se debe plantear la realización de un PET para confirmar o desmentir si hay enfermedad viable o es sólo necrosis (células muertas) o fibrosis. En lesiones residuales menores de 3 cm no es preciso ninguna intervención y basta con seguir al paciente de forma rutinaria.
- No seminoma: en estos pacientes, el tratamiento más habitual es administrar quimioterapia con 3 ciclos de BEP. También en estos pacientes pueden quedar restos de los ganglios linfáticos del retroperitoneo que no desaparecen por completo. En estos casos, cualquier lesión residual > 1 cm debe ser resecada y analizada mediante una intervención denominada linfadenectomía retroperitoneal, que puede ser llevada a cabo vía robótica, laparoscópica o abierta. En esta intervención se resecan los ganglios linfáticos de todo el espacio retroperitoneal, es decir, los ganglios ubicados alrededor de los grandes vasos del cuerpo (espacio presacro, espacio obturador, ilíacas, aorta, cava, y vasos renales). El PET no debe usarse como método diagnóstico en este contexto salvo situaciones muy excepcionales.
- Estadio III: En estos pacientes el tratamiento se realiza de forma similar tanto en tumores no seminomatosos como en seminomas. Estos pacientes se deben clasificar de acuerdo a los criterios de riesgo que presenten y tratar según el grupo de riesgo al que pertenezcan.
- Pacientes con pronóstico favorable: el tratamiento consiste en 3 ciclos de BEP o 4 de EP.
- Pacientes con pronóstico intermedio o desfavorable: el tratamiento consiste en 4 ciclos de BEP. En algunos pacientes se ofrecen otras alternativas, como esquemas de quimioterapia distintos o quimioterapia a dosis altas con soporte de progenitores de médula ósea, ocasionalmente en el contexto de ensayos clínicos, con el objetivo de intentar mejorar los resultados del tratamiento.
Seguimiento y controles
Después del tratamiento del cáncer de testículo es muy importante realizar revisiones periódicas. Las revisiones son más intensas en los pacientes con estadio I en los que no se administra tratamiento complementario después de la cirugía, porque su riesgo de recurrencia es mayor. En estos pacientes, es frecuente que se realicen controles cada 2 meses, o incluso cada mes, durante el primer y segundo año del diagnóstico.
En las revisiones, además de preguntar por los síntomas y de llevar a cabo una exploración física, suele realizarse una determinación de los marcadores tumorales de los tumores de testículo. Además, de forma periódica, suele realizarse radiografía de tórax, TAC abdominal y una ecografía de testículo. Según la extensión de la enfermedad al diagnóstico y los síntomas que presente el paciente se pueden añadir otras pruebas distintas.
La frecuencia de las revisiones suele ser variable y su duración es un tema de debate.
La realidad es que el mayor riesgo de que la enfermedad reaparezca se da en los primeros 2 años tras el diagnóstico. Transcurridos los 5 años [que hoy en día se considera un punto de referencia muy común en oncología] el riesgo de recaída es bajo.
Cáncer de vejiga
El cáncer de vejiga es un tumor mucho más frecuente de lo que a veces nos transmiten las estadísticas o los medios de comunicación. Ocupa el noveno lugar en cuanto al número de diagnósticos de cáncer a nivel mundial., y el quinto en Europa.
La media de edad al diagnóstico se encuentra en torno a los 70 años. Curiosamente existen diferencias geográficas marcadas, siendo los tumores de la vía urinaria mucho más frecuentes en el oeste europeo (incluida España) y América del Norte, que en Asia o Europa del Este.
La mayoría de estos tumores se diagnostican en fases precoces de desarrollo y se pueden curar con cirugías más o menos extensas. Sin embargo, cuando el tumor está más avanzado, la curación puede ser más complicada y los objetivos del tratamiento cambian hacia prolongar la supervivencia y mejorar la calidad de vida del enfermo.
Factores de riesgo
La principal causa conocida del cáncer de vejiga es el tabaco, al que se atribuyen en torno al 50% de todos los casos diagnosticados. El tabaco no sólo afecta nuestra vía respiratoria a través del humo. Y no sólo el consumo, sino que la exposición ambiental al tabaco también puede ser considerada como un factor de riesgo. Más de 60 productos carcinógenos contenidos en los cigarrillos son absorbidos y eliminados por la orina afectando en gran medida a las células de la pared de nuestra vía urinaria.
Existen otros factores de riesgo, pero la mayoría de ellos no son habituales en nuestro medio. Entre estos factores se incluye la exposición a algunas sustancias químicas de uso industrial (ciertos metales, tintes y gomas); la exposición a fármacos como la ciclofosfamida, o la esquistosomiasis, una infección producida por un parásito que suele encontrarse en África y ciertas regiones de América Latina.
No se ha demostrado de forma clara que la presencia de antecedentes familiares de cáncer de vejiga aumenta el riesgo de desarrollar la enfermedad en otros miembros de la misma familia, aunque el diagnóstico en pacientes menores de 60 años debería considerarse con especial atención.
Prevención
La mejor manera de prevenir el cáncer de vejiga es evitar el consumo de tabaco, dado que como hemos comentado es el factor de riesgo más importante para desarrollar la enfermedad.
No se realizan estudios de forma rutinaria en personas sanas para diagnosticar el cáncer de vejiga de forma precoz, porque no existe evidencia de que esto sea realmente beneficioso.
Tipos histológicos
Los tipos histológicos son las distintas clases de tumores que se pueden desarrollar en un órgano, determinadas en función de las características microscópicas del tumor.
En el caso de los tumores de vejiga el principal tipo histológico es el carcinoma urotelial, cuyas células derivan de la mucosa que recubre por dentro a la vejiga (epitelio transicional o urotelio). Al igual que en otros órganos, pueden aparecer tumores derivados de muchas otras células, incluyendo el carcinoma escamoso (que se forma sobre células planas que aparecen en la vejiga cuando hay irritación de la misma), el adenocarcinoma (tumores que se forman a partir de glándulas), los carcinomas de células pequeñas y otros todavía menos frecuentes. En este documento nos referiremos a los tumores uroteliales, por ser con mucha diferencia los más comunes.
Los tumores derivados de la vía urinaria superior (uréter y pelvis renal) también suelen ser uroteliales. Son muy similares en su comportamiento biológico al cáncer de vejiga y su manejo, salvo aspectos técnicos concretos, es muy similar.
Sintomatología
El síntoma principal para sospechar un cáncer de vejiga es la aparición de sangre en la orina (hematuria) sin dolor asociado durante la micción. La aparición de sangre en la orina puede detectarse a simple vista (hematuria macroscópica) o en un análisis de orina (hematuria microscópica). Aunque existen varios procesos no tumorales por los que puede aparecer sangre en la orina, incluyendo los cálculos en la vía urinaria y las infecciones de orina, la hematuria es un síntoma importante por el que siempre se debe consultar con un médico.
Los tumores de vejiga también pueden dar como síntomas molestias urinarias, incluyendo necesidad de orinar con más frecuencia y en poca cantidad, dolor o escozor al orinar, o ganas de orinar justo después de acabar de hacerlo; y todo ello sin necesidad de provocar hematuria asociada. Estos síntomas son muy inespecíficos, y pueden estar presentes en otras patologías mucho más comunes y de comportamiento benigno, como la hiperplasia prostática benigna, las infecciones urinarias o la vejiga hiperactiva.
Cuando existen metástasis en otros órganos, éstas pueden producir síntomas muy variados, dependiendo de su localización. Los sitios más frecuentes en los que aparecen metástasis del cáncer de vejiga son los huesos y el pulmón, aunque también pueden aparecer en el hígado, cerebro y casi cualquier órgano.
Diagnóstico
Cuando se sospecha un cáncer de vejiga, además de preguntar por los síntomas y explorar al paciente, deben realizarse ciertas pruebas complementarias para confirmarlo y para determinar el subtipo tumoral y el estadio de la enfermedad.
- Analítica general de sangre: es especialmente importante controlar la función del riñón, porque en los pacientes con cáncer de vejiga con frecuencia está alterada. La función del riñón se determina con una prueba analítica llamada creatinina y filtrado glomerular. Además, la hematuria puede generar anemia u otras alteraciones que también serán visibles en este examen.
- Citología seriada de orina: la presencia de células uroteliales malignas en la orina detectadas mediante un estudio citológico confirma el diagnóstico. Sin embargo, la citología de orina no es muy sensible, y suele haber enfermos con cáncer de vejiga sin alteraciones destacables en su analítica de orina, sobretodo en aquellos pacientes que se diagnostican de tumores de bajo grado.
- Ecografía abdominal y de la vía urinaria (Ecografía reno-vésico-prostática): permite observar con detalle los riñones, uréteres y la vejiga siempre que se encuentren llenos de orina. Es una prueba no invasiva e inocua para el paciente que en muchos casos es capaz de detectar los tumores vesicales, y evaluar su alcance sobre la vía urinaria o el resto de órganos abdominales.
- Cistoscopia: la cistoscopia es el método “gold estándar” para el diagnóstico y estadificación local del cáncer de vejiga. Consiste en introducir en la vejiga a través de la uretra un tubo flexible equipado con una pequeña cámara de vídeo. Esto nos permite observar el interior de la vejiga, e incluso se pueden realizar algunas intervenciones, como quitar pólipos, tomar biopsias, etc. Se puede realizar en quirófano ambulatorio, sin necesidad de anestesia general.
- Tomografía axial computarizada (TAC) del tórax y/o resonancia nuclear magnética (RM) del abdomen y de la pelvis: suele realizarse especialmente si existe sospecha de que el tumor haya avanzado hasta capas más profundas de la vejiga. Estos estudios permiten determinar el estadio tumoral.
Además, pueden realizarse en algunos casos:
- TAC o RM cerebral: si se sospecha la existencia de metástasis cerebrales.
- Gammagrafía ósea: si pueden existir metástasis óseas.
Como técnica de diagnóstico y tratamiento se realiza en todos los casos, salvo excepciones:
- Resección transuretral de tumor vesical (RTU): consiste en una operación para poder observar el interior de la vejiga y realizar resecciones con más profundidad, y así estadiar hasta qué capa ha llegado dicho tumor. Es una intervención que requiere anestesia, pero también se lleva a cabo a través de la uretra y supone una mínima agresión para el paciente
Estadificación
En general, todos los tumores se clasifican en varios estadios (en función de parámetros como su tamaño, órganos afectos, diseminación a distancia, etc.) que tendrán una evolución diferente y requerirán tratamientos distintos. En el caso del cáncer de vejiga la clasificación más empleada es el sistema TNM, que valora la extensión del propio tumor (T, tumor primario), los ganglios linfáticos (N, del inglés nodes o ganglios) y la presencia de metástasis (M).
De forma sencilla, se distinguen los siguientes estadios:
- Tumor vesical no músculo-invasivos (TVNMI) o “superficiales” :son tumores que no invaden la capa externa de la vejiga (capa muscular), aunque sí pueden invadir las capas internas de la vejiga (mucosa o submucosa).
- Tumor vesical músculo-invasivo (TVMI) o “infiltrante”: el tumor invade el músculo de la vejiga. Este hecho implica una posibilidad mayor de que se extienda a otras partes del cuerpo, produciendo metástasis.
- Tumor vesical localmente avanzado: el tumor invade el tejido que rodea a la vejiga o invade órganos vecinos como la próstata, el útero o la vagina.
- Tumor vesical metastásico: el tumor se halla diseminado afectando a los ganglios linfáticos o presenta metástasis a distancia en otros órganos del cuerpo.
El estadio de cada caso marca de forma muy significativa la evolución esperable de cada paciente. No obstante, no todos los pacientes con un mismo estadio evolucionan de la misma forma y, en el curso particular de cada caso, también tendrán mucha relevancia otros factores pronósticos, tratamientos recibidos, características del paciente, etc.
Pronóstico
Los factores pronósticos son características del tumor y del paciente que permiten estimar a priori su evolución posterior, complementando el estadio marcado por el sistema TNM.
En los tumores en fases iniciales un factor pronóstico importante es el grado tumoral. Se dice que un tumor es de bajo grado cuando, visto al microscopio, se parece mucho al tejido desde el cual se originó (en este caso, el tejido normal que recubre la vejiga o urotelio); y un grado más alto cuando sus células están tan estropeadas y desestructuradas que casi no se parecen en nada al tejido original. Actualmente los tumores uroteliales se dividen únicamente entre alto o bajo grado. Los tumores de alto grado son más agresivos y tienen mayor riesgo de volver a aparecer después del tratamiento.
Tampoco todos los pacientes con tumores en fases avanzadas tienen la misma evolución. Se sabe que los pacientes que, cuando son diagnosticados, tienen peor estado general, anemia, valores de albúmina en sangre bajos y/o metástasis a distancia viscerales (especialmente en hígado) tienen un peor pronóstico y se puede esperar una menor supervivencia.
Tratamiento
El tratamiento de los tumores de vejiga se realiza en función del estadio que presentan.
- Tumor vesical no músculo-invasivos (TVNMI) o “superficiales”:
Los pacientes con tumores de vejiga en estadios “superficial” se curan con el tratamiento adecuado en la mayoría de los casos, aunque tienen un riesgo alto de volver a reaparecer. En función del grado del tumor y la presencia de otros factores, el tratamiento puede consistir únicamente en extirpar el tumor mediante cistoscopia o resección transuretral o, en otros casos, y administrar tratamiento complementario con inmunoterapia o quimioterapia directamente dentro de la vejiga, a través de una sonda vesical, mediante una o varias instilaciones. Estos tratamientos intravesicales reducen el riesgo de recidiva tumoral y de progresión del tumor de “superficial” a infiltrante
- Tumor vesical músculo-invasivo (TVMI) o “infiltrante”:
El principal problema de estos pacientes es que presentan un riesgo relativamente alto de que la enfermedad produzca metástasis a distancia, y por tanto, que esto afecte a su supervivencia. Existen varias opciones de tratamiento:
- Cistectomía radical: consiste en extirpar la vejiga, órganos y ganglios linfáticos cercanos. Es el tratamiento más habitual. Puede realizarse vía abierta, laparoscópica o robótica. Su mayor inconveniente es que, al eliminar la vejiga, no es posible orinar de forma normal. Las soluciones más frecuentemente utilizadas para reconstruir la vía urinaria son:
- Realizar una ureteroileostomía o Bricker: consiste en desviar los uréteres a un fragmento de intestino delgado (íleon), que desembocará en la piel, formado una ostomía.. A dicho orificio (ostomía) se fija mediante un anillo adhesivo una bolsa de plástico para recoger la orina y la bolsa se va vaciando de forma periódica.
- Realizar una neovejiga: con tejido del intestino delgado (íleon) del propio paciente se realiza una bolsa a la que se conectan los uréteres. La orina llega hasta esta neovejiga situada en el interior del abdomen y puede salir al exterior a través la propia uretra del paciente que se vuelve a conectar a la neovejiga. No siempre es posible realizar esta última técnica y en algunos casos se asocia a complicaciones.
Durante los últimos años, se están estandarizando las técnicas mínimamente invasivas para el tratamiento del tumor vesical infiltrante. La cistectomía robótica ha demostrado que presenta menores complicaciones en el postoperatorio, con menor sangrado intraoperatorio, menos tasa de transfusión, y menores tasa de íleo paralítico. La cistectomía con robot Da Vinci, a su vez, ha permitido una pronta recuperación del paciente, permitiendo una disminución de días de ingreso hospitalario, dado que las complicaciones postoperatorias son menores, manteniendo unos resultados oncológicos de calidad. Estas técnicas requieren de gran experiencia quirúrgica en este ámbito. Por tanto, menor agresividad quirúrgica con cirugía robótica, y un equipo experto, dan los mejores resultados.
- Tratamiento conservador de preservación vesical: consiste en eliminar el tumor evitando quitar la vejiga, para aumentar la comodidad del paciente. Estas técnicas sólo se pueden realizar en algunos pacientes muy seleccionados tanto por la situación de la enfermedad, como por la situación del propio paciente, y deben ser llevadas a cabo por equipos con experiencia y buena coordinación. Cuando se realizan, debe llevarse a cabo un seguimiento muy completo del paciente, para identificar las posibles reapariciones del tumor. Existen varias alternativas:
- Quimiorradioterapia: los tumores de vejiga son sensibles a la radioterapia y en algunos casos pueden eliminarse con este tratamiento, que habitualmente se administra de forma simultánea con quimioterapia.
- Resección transuretral: en casos excepcionales, cuando la invasión tumoral no es demasiado profunda, puede ser una alternativa, pero no se trata de un manejo estándar.
- Terapia trimodal: Es la opción más recomendable en el caso de optar por preservación vesical. Consiste en llevar a cabo una RTU amplia que permita eliminar cualquier resto tumoral, y a continuación, llevar a cabo el tratamiento con quimio-radioterapia concomitante.
- Tratamiento complementario: como se ha comentado, uno de los principales problemas de estos tumores es que pueden reaparecer, bien en la zona inicial (recidiva local) o en otras partes del cuerpo (metástasis). Esto ocurre porque a pesar del tratamiento inicial, puede persistir enfermedad microscópica, que no podemos detectar en las pruebas realizadas al diagnóstico. Para intentar disminuir el riesgo de que reaparezca el tumor, se puede administrar tratamiento complementario con quimioterapia. El tratamiento complementario no siempre se administra, depende del estadio de la enfermedad y de las características del paciente. El tratamiento se puede realizar de dos formas:
- Tratamiento adyuvante o adyuvancia: administración de quimioterapia después de extirpar el tumor. Su capacidad para disminuir el riesgo de que la enfermedad reaparezca no es absoluta, pero existen datos que apoyan su uso. Hay, además, algunos ensayos clínicos en marcha para intentar aumentar nuestro conocimiento sobre este tema sobre el uso de inmunoterapia sistémica con inhibidores de los puntos de control del sistema inmune.
- Tratamiento neoadyuvante o neoadyuvancia: administración de quimioterapia antes de extirpar el tumor. Los resultados de algunos ensayos clínicos indican que disminuye el riesgo de que vuelva a aparecer la enfermedad e impacta en la supervivencia y evolución a largo plazo de estos pacientes. Su principal desventaja es que retrasa la operación. El uso de inmunoterapia sistémica como tratamiento neoadyuvante de estos pacientes sí está obteniendo resultados prometedores.
- Tumor vesical localmente avanzado:
El tratamiento es similar, pero suele ser más agresivo y suele consistir en cistectomía radical, radioterapia o quimiorradioterapia. Otras técnicas menos agresivas como la resección transuretral o la cistectomía parcial, no suelen emplearse. También debe aplicarse tratamiento complementario con quimioterapia o inmunoterapia en la mayoría de los casos.
- Tumor vesical metastásico:
El objetivo del tratamiento es controlar o retrasar la aparición de los síntomas y aumentar la supervivencia de los pacientes. El tratamiento con cirugía, además de ser más complicado, no consigue la curación de la enfermedad, por lo que no suele realizarse salvo con una intención paliativa en casos muy seleccionados. Las opciones de tratamiento incluyen:
- Quimioterapia: tradicionalmente ha sido el tratamiento empleado con más frecuencia en esta fase de la enfermedad aunque la llegada de nuevas alternativas para estos pacientes está suponiendo un gran cambio en las guías de manejo clínico de estos pacientes. Las combinaciones de quimioterápicos más activas y por tanto deseables son aquellas que contienen cisplatino. En general suele administrarse junto a gemcitabina, pero también se usa combinado con metrotexate, vinblastina y adriamicina, o con gemcitabina más paclitaxel. No obstante, no todos los pacientes resultan buenos candidatos (“fit”) para ser tratados con cisplatino. Los enfermos con cierto grado de insuficiencia renal, mala situación funcional, hipoacusia, daño nervioso persistente sobre nervios periféricos y/o insuficiencia cardiaca son considerados no aptos (“unfit”) para recibir tratamiento con cisplatino. En estos casos los agentes quimioterápicos tradicionalmente empleados han sido combinaciones con carboplatino; aunque en el momento actual debería considerarse el uso de inmunoterapia si el perfil biológico de la enfermedad lo permite. Vinflunina o paclitaxel son quimioterápicos hasta ahora empleados en segunda línea, y podrían continuar siendo una alternativa para estos pacientes a tener en cuenta en algún momento de la secuencia de tratamientos. Sin embargo, diversos estudios han demostrado que la inmunoterapia sistémica con inhibidores check-point resulta superior a estos quimioterápicos, en pacientes cuyo tratamiento en primera línea con cisplatino ha fracasado.
- Inmunoterapia: la llegada de la inmuno-oncología es ya una realidad y el uso de los inhibidores de los check-point del sistema inmune ha cambiado el tratamiento del cáncer de vejiga. La base de estos tratamientos es infundir fármacos al paciente que modulen la respuesta de su propio sistema inmune contra el tumor, de manera que nuestras propias defensas sean capaces de eliminar las células malignas. Cinco fármacos diferentes de esta familia (pembrolizumab, atezolizumab , nivolumab, durvalumab y avelumab) ya demostraron ser activos, y en muchos casos superiores a la quimioterapia clásica, para aquellos pacientes con tumores previamente ya tratados con platino, es decir, en el escenario de la segunda línea de tratamiento. También en pacientes no previamente tratados, no candidatos a cisplatino, y cuyos tumores expresen de forma significativamente elevada la proteína “PD-L1”, el uso de inhibidores de check-point del sistema inmune ha demostrado ser la opción más apropiada de tratamiento. Recientemente se han comunicado resultados muy prometedores de la combinación de quimioterapia junto con atezolizumab en primera línea de tratamiento, de manera que es posible que en un futuro próximo pueda plantearse como una realidad para los pacientes.
- Terapia dirigida: los tumores uroteliales son neoplasias que suelen albergar múltiples alteraciones genéticas subyacentes. El conocimiento de éstas nos ha permitido generar una clasificación molecular de diferentes subtipos de cáncer de vejiga. Por otra parte, dichos avances han permitido desarrollar drogas inhibidoras de alteraciones genéticas concretas (como erdafatinib para el caso de las mutaciones en el gen FGFR; u otros fármacos relacionados con la vía de PTEN ó MTOR) cuyos resultados en cáncer de vejiga están resultando muy positivos y probablemente puedan utilizarse a corto plazo para el tratamiento de estos enfermos.
- Inmunoconjugados: se trata de compuestos que unen un agente de quimioterapia a un anticuerpo específicamente dirigido contra una diana específica del tumor. De esta forma, se vehiculiza a la quimioterapia contra la neoplasia incrementando su actividad y evitando su toxicidad al no actuar sobre tejidos sanos. Enfortumab-Vedotin es un claro ejemplo de un inmunoconjugado muy eficaz en cáncer de vejiga, por lo que es posible que se incorpore en un futuro no lejano a las alternativas de tratamiento hoy vigentes para cáncer urotelial.
- Radioterapia: puede emplearse de forma paliativa para tratar algunos síntomas de difícil control como dolor, sangrado importante por la orina, etc.…
Seguimiento
Después del tratamiento del cáncer de vejiga es muy importante realizar revisiones periódicas. Las revisiones en los pacientes en los que no se extirpa la vejiga, suelen incluir cistoscopia y citologías seriadas de orina para detectar las posibles recaídas en la propia vejiga lo antes posible.
En las revisiones, además de la recogida de síntomas y de la exploración física, suele realizarse de forma periódica alguna prueba de imagen incluyendo radiografía de tórax, TAC abdominal y de tórax o ecografía de abdomen y de vías urinarias. Según la extensión de la enfermedad en el momento del diagnóstico y los síntomas que presente el paciente, se pueden añadir otras pruebas distintas.
Cáncer de próstata
El cáncer de próstata es una enfermedad que se desarrolla principalmente en varones de edad avanzada. Suele ser asintomático salvo en estadios avanzados de la enfermedad.
El cáncer de próstata es el más frecuente de todos los cánceres entre los varones.
Factores de riesgo
- Edad: la edad es el principal factor de riesgo para el cáncer de próstata. El riesgo de desarrollar un cáncer de próstata empieza a aumentar a partir de los 50 años en hombres de raza blanca y a partir de los 40 años en hombres de raza negra o con historia familiar (padre o hermano) de cáncer de próstata. Casi dos de cada tres casos de cáncer de próstata se detectan en hombres mayores de 65 años.
- Raza: el cáncer de próstata es más frecuente en hombres de raza negra que en hombres de otras razas. Además, los hombres de raza negra tienen una mayor probabilidad de ser diagnosticados en una etapa avanzada, y tienen más del doble de probabilidad de morir de cáncer de próstata en comparación con los hombres blancos. Por otra parte, la tasa más baja de cáncer de próstata se observa en individuos de raza asiática.
- Historia familiar: el riesgo de cáncer de próstata está fuertemente influenciado por la historia familiar. Aquellos hombres que tienen un familiar de primer grado (padre o hermano) diagnosticado de cáncer de próstata tienen más probabilidad de desarrollar la enfermedad. Tan sólo un 5-10% de los cánceres de próstata tienen un componente hereditario. En el cáncer de próstata hereditario la edad de aparición del cáncer es más precoz (antes de 55 años) y a menudo los pacientes tienen familiares de primer grado afectos de cáncer de próstata. Se han descubierto genes implicados en una mayor susceptibilidad al desarrollo de un cáncer de próstata.
- Dieta: recientes estudios sugieren que el consumo elevado de grasas animales puede aumentar el riesgo de padecer cáncer de próstata.
Prevención
Se han estudiado diversos factores que puedan prevenir la aparición de cáncer de próstata. Ninguno de ellos , ya sean suplementos dietéticos, fármacos, actividad física o sexual, se puede actualmente recomendar como factor demostrado en la prevención del cáncer de próstata.
Síntomas
En las primeras fases, cuando el tumor está limitado a la próstata, puede ser asintomático o acompañarse de síntomas obstructivos leves atribuibles a una hiperplasia benigna (disminución del calibre o interrupción del chorro de orina; aumento de la frecuencia de la micción, sobre todo nocturna; dificultad para orinar o escozor durante la micción), dado que puede coexistir el cáncer de próstata y la hipertrofia benigna de la próstata.
Cuando los tumores son localmente avanzados se acompañan de síntomas obstructivos claros, además puede haber hematuria (sangre en la orina) o signos de infección (estos dos últimos son poco frecuentes).
Cuando se trata de tumores avanzados puede aparecer edema o hinchazón de piernas (debido al crecimiento de ganglios linfáticos regionales), dolores óseos (por extensión tumoral al hueso) e incluso debilidad o pérdida de fuerza en piernas (compresión de la médula espinal).
Diagnóstico
Para el diagnóstico se utiliza el examen físico y las pruebas complementarias.
- Tacto rectal: consiste en un examen del recto mediante el cual el médico inserta un dedo dentro de un guante lubricado en el recto y palpa la próstata a través de la pared rectal en busca de nódulos o áreas anormales. La glándula prostática se encuentra inmediatamente delante del recto, y la mayoría de los cánceres comienzan en la parte posterior de la glándula, lo que se puede palpar durante un examen del recto. Este examen es incómodo, pero no es doloroso y lleva muy poco tiempo realizarlo..
Determinación de los niveles en sangre de PSA (PSA total y cociente de PSA): prueba de laboratorio que mide las concentraciones de este marcador (Proteína Específica de la Próstata) en sangre. Es una sustancia producida específicamente por la próstata que se puede encontrar en mayor cantidad en la sangre de los hombres que tienen cáncer de la próstata. Sin embargo, hay que tener en cuenta que los niveles de PSA también se puede elevar en una infección o una inflamación de la próstata como la hiperplasia prostática benigna (aumento de tamaño de la próstata de origen no canceroso). El screening con PSA, aunque ha sido un tema controvertido en el mundo científico urológico, ha demostrado un beneficio al aumentar los casos diagnosticados, disminuyendo las muertes atribuidas a pacientes no diagnosticados. Pacientes con PSA < 10 ng/ml tienen 70-80% de probabilidad de que la enfermedad esté localizada, si los niveles de PSA oscilan entre 10-50 ng/ml el 50% estarán localizados, si el PSA es > 50 ng/ml tan sólo un 25% estarán localizados.
- Resonancia nuclear magnética (RM): procedimiento en que se utiliza un imán, ondas de radio y una computadora para crear una serie de fotografías detalladas de zonas internas del cuerpo. Debido a los últimos avances en la clasificación PIRADS, se ha convertido en una prueba fundamental, útil para el diagnóstico y necesarias para la realización de biopsias de próstata por fusión de imágenes. Por otro lado, es útil en la evaluación de la extensión del tumor dentro de la pelvis.
Biopsia prostática
Normalmente se realiza guiada por ecografía transrectal. Cuando existe sospecha de cáncer, es necesario extraer una pequeña cantidad de tejido prostático para examinarla al microscopio. Esta prueba permitirá confirmar el diagnóstico de cáncer y nos dará idea del volumen tumoral y el grado de agresividad (puntuación Gleason).
- Gleason 6: tumores de bajo grado
- Gleason 7: tumores de grado intermedio
- Gleason 8-10: tumores indiferenciados
Biopsia prostática por fusión de imágenes
La Biopsia por fusión es una técnica que permite fusionar en tiempo real las imágenes de la RM prostática con la ecografía transrectal, lo que permite localizar exactamente la zona nodular sospechosa dentro de la próstata y, por tanto, mejor precisión en el diagnóstico de cáncer de próstata, al permitir la punción exacta de dicha zona sospechosa.
Estadificación
Sin tratamiento, la supervivencia del cáncer de próstata depende de la edad al diagnóstico, estado general de salud, grado tumoral y estadio al diagnóstico.
Entre los pacientes no tratados con cáncer de próstata localizado, los que tienen una baja puntuación de Gleason (6) tienen muy bajo riesgo de morir de su cáncer en los próximos 15 años (4-7%) independientemente de la edad del paciente en el momento del diagnóstico; sin embargo, los que tienen un tumor indiferenciado con Gleason 8-10, tienen una mayor probabilidad de morir de su cáncer frente a otras causas, aunque el diagnóstico sea en edades avanzadas.
El proceso que se emplea para definir si el cáncer se ha extendido dentro de la próstata o a otras partes del organismo se llama estadificación. Es importante conocer el estadio o etapa de la enfermedad con el fin de planificar el tratamiento. Para descartar afectación ósea, se realiza la gammagrafía ósea, y para descartar la afectación visceral o adenopática, se utiliza la tomografía axial (TAC).
Modelos predictivos
Utilizan el PSA, la puntuación de Gleason y el estadio T para predecir la probabilidad de que el paciente esté libre de enfermedad tras el tratamiento local, de manera que los pacientes pueden incluirse dentro de 3 grupos pronósticos:
- Bajo riesgo: T1-T2a, Gleason 6 y PSA < 10 ng/ml. Más del 85% de los pacientes están libres de enfermedad a los 5 años del tratamiento con cirugía o radioterapia.
- Riesgo intermedio: T2b y/o Gleason 7 y/o PSA 10-20. El 50-70% estarán libres a los 5 años.
- Alto riesgo: T3 o superior o Gleason 8-10 o PSA > 20. Tan solo el 33% permanecerán libres de enfermedad tras el tratamiento local.
Tratamiento
Existen tres estrategias consideradas estándar para el manejo del cáncer de próstata localizado:
- Cirugía
- Radioterapia con/sin hormonoterapia
- Vigilancia activa
La elección del tratamiento depende de varios factores:
- La probabilidad de que el tumor esté limitado a la glándula prostática y por lo tanto sea potencialmente curable.
- El tamaño tumoral y el grado histológico (grado de agresividad del tumor).
- Edad del paciente y estado general, así como enfermedades asociadas.
- Potenciales efectos secundarios de las diferentes formas de tratamiento.
Evaluación pretratamiento
Antes de elegir la mejor opción terapéutica es primordial que la extensión de la enfermedad esté correctamente evaluada.
Los más importantes factores para predecir la evolución de la enfermedad antes del tratamiento son el estadio, el nivel de PSA en sangre, el volumen tumoral (nº de biopsias positivas y porcentaje del material obtenido en la biopsia que está afectado por el tumor) y el grado de agresividad del tumor, referido como puntuación de Gleason.
Cirugía: prostatectomía radical (PR)
Consiste en extraer completamente la glándula prostática y las vesículas seminales. Existen 3 maneras de realizarla: por vía abierta, por vía laparoscópica o por vía robótica.
La Prostatectomía por Robot DaVinci, es la técnica menos invasiva y con mayor precisión que existe para la extirpación prostática. En esta cirugía, se introducen unos trócares en el abdomen del paciente, en los cuales se acoplan los brazos robóticos, que el cirujano controla desde una consola externa integrada., El hecho de que el Robot Da Vinci permita una visión tridimensional real, asociado al hecho de que los brazos permitan realizar todos los grados de movimiento dentro del abdomen del paciente, son las principales ventajas de esta técnica, respecto a la técnica abierta y laparoscópica. La Prostatectomía Robótica, gracias a estas ventajas, permite un mejor postoperatorio inmediato, así como una disminución en la tasa de Incontinencia urinaria y disfunción eréctil. El hecho de que sea un procedimiento tan preciso permite preservar el esfínter urinario de manera íntegra, con lo que disminuyen de manera muy significativa las tasas de incontinencia urinaria, así como preservar las bandeletas neurovasculares, lo que ocasionará menor impacto durante el postoperatorio por lo que se refiere a la disfunción eréctil o impotencia.
A su vez, permite realizar linfadenectomías extendidas, es decir, extirpación de ganglios linfáticos, en aquellos casos que se requieran.
La Prostatectomía Laparoscópica 3D, es una técnica mínimamente invasiva, que ha evolucionado durante los últimos años. De la misma manera que en la prostatectomía por robot, permite una extirpación de toda la glándula, aunque la capacidad de preservar las estructuras implicadas en la continencia urinaria y en la función eréctil, no es tan precisa.
Ambas técnicas permiten un buen control de la enfermedad oncológica.
Actualmente la prostatectomía radical abierta está en desuso, debido a sus comorbilidades.
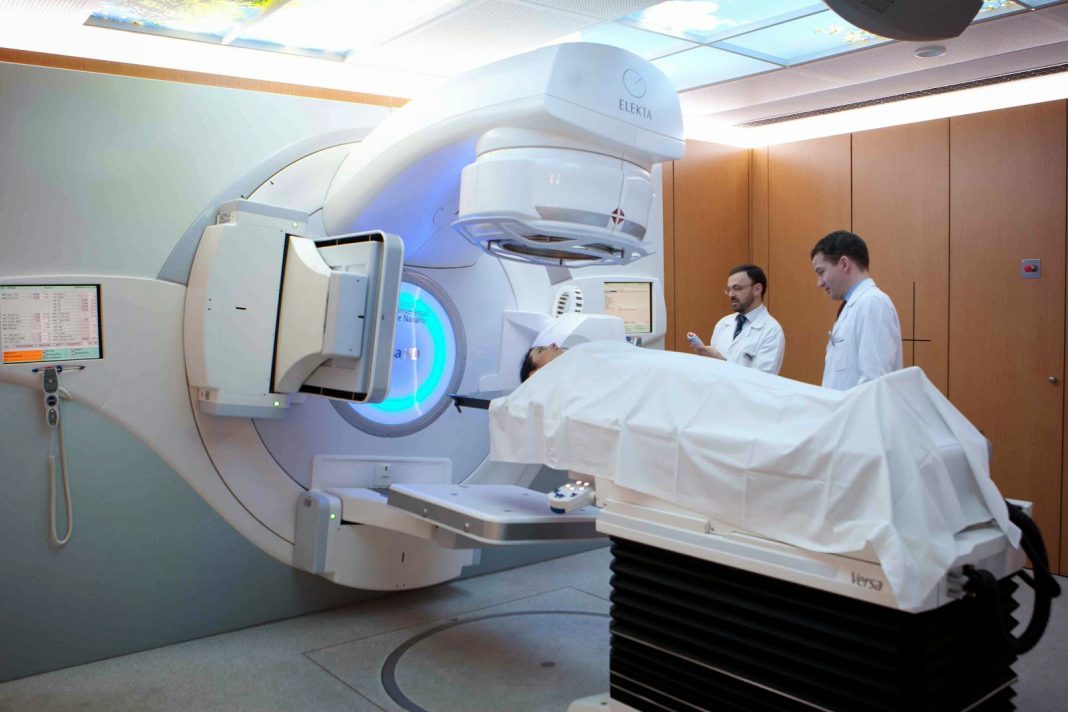
Radioterapia (RT)
Se utilizan dos formas de RT para tratar el cáncer de próstata:
- Radioterapia externa
- Braquiterapia o RT de implantación intersticial
Radioterapia externa: utiliza una máquina denominada acelerador lineal que se mueve alrededor del paciente dirigiendo la radiación a la pelvis. Se administra a diario (5 días a la semana) durante 4 a 7 semanas (depende de si se utiliza sola o en combinación con braquiterapia). No requiere hospitalización.
Complicaciones de la RT: son consecuencia de la pequeña cantidad de radiación que reciben los tejidos sanos cercanos al tumor (vejiga y recto, sobre todo); con los nuevos avances tecnológicos se han ido minimizando cada vez más. Las más frecuentes son:
- Aumento de la frecuencia miccional y sensación de urgencia miccional
- Dolor al orinar
- Impotencia, en este caso más frecuente a medida que transcurre tiempo desde la RT.
- Problemas intestinales (diarrea, dolor y sangrado, los dos últimos secundarios a la inflamación producida en el recto denominada proctitis)
Con objeto de reducir los efectos secundarios de la radioterapia externa clásica, se han ido mejorando las técnicas de irradiación y existen hoy en día nuevas formas de administrar la radiación que no están disponibles en todos los centros:
- RT conformada o tridimensional (RTC-3D): se ha convertido en tratamiento estándar tras la publicación de numerosos estudios clínicos. Permite administrar dosis más altas en la próstata, respetando los tejidos que están alrededor, por lo tanto, disminuye la tasa de efectos secundarios, sobre todo los problemas intestinales.
- RT de intensidad modulada (IMRT): permite variar (escalar) la dosis de RT y la intensidad durante la terapia. Reduce los efectos secundarios y facilita el tratamiento cuando hay que incluir los ganglios linfáticos pélvicos en el campo. Permite administrar dosis muy elevadas (81 Gy) con poca toxicidad intestinal. Esta técnica no está disponible en todos los centros por su coste elevado.
- Braquiterapia o RT de implantación intersticial: consiste en administrar una fuente radiactiva dentro de la próstata guiada por ecografía. Ventajas: se realiza en un tiempo corto y precisa poca estancia hospitalaria. Las series publicadas parecen indicar que es un buen tratamiento sólo para pacientes con tumores de bajo riesgo.
Complicaciones de la braquiterapia: ocasiona un síndrome urinario agudo (de corta duración) provocado por la inflamación de la próstata, que incluso puede provocar retención aguda de orina. Provoca menos incontinencia que la RT externa, menos problemas a nivel del recto. El riesgo de impotencia es similar al de los otros tratamientos.
- Radioterapia guiada por la imagen (IGRT): permite también la administración de dosis más altas de radioterapia externa (incluso llegar hasta 90Gy) mediante la utilización de técnicas de imagen avanzada como la resonancia magnética con espectroscopia..
Vigilancia activa
Es una opción válida en ciertos casos como pacientes que presentan tumores pequeños, con bajo Gleason, lento ascenso de los niveles de PSA, e imágenes en la resonancia que no demuestren progresión. Por tanto, es indicado en aquellos pacientes que tienen tumores de bajo riesgo
No es una opción adecuada para pacientes con tumores de riesgo intermedio o alto riesgo, es decir, pacientes con tumores grandes, Gleason alto, en los que el crecimiento tumoral es rápido y por lo tanto tienen una alta probabilidad de morir a causa de su cáncer de próstata.
El protocolo de vigilancia activa permite tener controlados a aquellos pacientes que tiene un cáncer de próstata de bajo riesgo, Durante el seguimiento, se realizan controles seriados de PSA, habitualmente cada 4-6 meses, así como Resonancias Magnéticas de próstata seriadas, habitualmente anuales, y Biopsias prostáticas también seriadas, anuales o bianuales, para descartar la progresión de la enfermedad. En el caso de que la enfermedad progrese, se realizará un tratamiento activo.
Aproximadamente el 50% de los pacientes que están en observación pasan a recibir tratamiento dentro de los tres primeros años ya sea por progresión o por la ansiedad de permanecer sin tratamiento.
Tratamiento hormonal: supresión androgénica
La próstata es un órgano dependiente en su crecimiento del nivel de hormonas masculinas, denominadas andrógenos (el más importante de los andrógenos es la testosterona).
La supresión o deprivación androgénica consiste en aplicar tratamientos que consigan disminuir al máximo los niveles de testosterona en el organismo, con ello se ha observado que disminuye el tamaño tanto de la próstata normal como de la próstata tumoral.
En distintos estudios se ha comprobado que añadir tratamiento hormonal antes o después del tratamiento local (RT) mejora los resultados en pacientes de riesgo intermedio y alto, no así en pacientes de bajo riesgo.
La duración del tratamiento es controvertida, normalmente el tratamiento se inicia 1 o 2 meses antes y se prolonga hasta 6 meses (casos de riesgo intermedio) o hasta 2 años (alto riesgo) con los datos disponibles hasta la fecha.
Los efectos secundarios del tratamiento de supresión androgénica son: disminución del deseo sexual, impotencia, sofocos, crecimiento del tejido mamario que puede ser doloroso, debilidad muscular, pérdida de masa ósea con riesgo aumentado de fracturas, anemia y un mayor riesgo de desarrollar diabetes o enfermedad coronaria.
Crioterapia
Es un tratamiento local que consigue destrucción de las células tumorales mediante aplicación de congelación en la glándula prostática.
Se aplica bajo anestesia local en quirófano y aunque los resultados son prometedores, no hay datos disponibles a largo plazo, por lo tanto, no puede ser recomendada como tratamiento estándar en el cáncer de próstata localizado como lo son la cirugía o la RT. Puede ser útil en caso de reaparición del tumor tras RT o cirugía previa.
Terapias focales
Dentro de los tratamientos alternativos que se pueden aplicar a paciente con cáncer de próstata de bajo riesgo son los tratamientos conocidos como terapias focales.. Estos tratamientos pueden ser fundamentalmente HIFU, aunque también existen tratamientos como la terapia fotodinámica, electroporación, crioterapia focal.
Fundamentalmente el HIFU (Ultrasonidos de alta frecuencia), permite, tras localizar la zona a tratar basado en las imágenes de resonancia magnética y biopsia prostática por fusión, realizar un tratamiento focal, sólo en la zona afectada por el tumor. Estas terapias actualmente son consideradas en fase investigacional, aunque existen cierto perfil de pacientes que se podrían beneficiar de ello.
Cáncer de próstata avanzado
Aproximadamente un 15-20% de los pacientes con cáncer de próstata se presentan en el momento del diagnóstico en fase avanzada, es decir, el tumor se ha extendido más allá de la glándula invadiendo órganos vecinos por continuidad (cáncer de próstata localmente avanzado que corresponde a tumores T3, T4 de la clasificación TNM) o bien afecta a los ganglios linfáticos regionales (estadios III) e incluso invade otros órganos a distancia (cáncer de próstata metastásico o estadio IV).
Por otro lado, los pacientes que en una fase inicial presentan tumores localizados, pueden presentar recurrencia o recaída de su enfermedad, tratándose entonces también de una enfermedad avanzada.
Tratamiento del cáncer de próstata localmente avanzado (T3, T4)
Las opciones de tratamiento recomendadas incluyen:
- RT externa con o sin braquiterapia
- Resección transuretral (RTU) de la próstata
- Prostatectomía radical
- Terapia hormonal basada en supresión androgénica: normalmente en combinación con cirugía y RT.
Cirugía
- Prostatectomía radical (PR): como hemos dicho antes, consiste en extraer completamente la glándula prostática. Se realizan dentro de una modalidad que se denomina “tratamiento multimodal”. Dado que la enfermedad no está sólo localizada dentro de la próstata, se propone realizar tras la cirugía, tratamiento con RT, o combinación de RT más HT, en función de las características del tumor tras extraer la próstata. Esto nos permite disminuir la tasa de recidiva local. Se puede realizar la prostatectomía radical con robot también en pacientes con cáncer de próstata localmente avanzado
Radioterapia
- RT externa: Se considera otra alternativa en los pacientes con tumores localmente avanzados son tratados con RT externa en combinación con tratamiento de supresión androgénica. En cuanto a la duración óptima del tratamiento hormonal hay controversia: se debe iniciar dos meses antes de la RT y la duración oscila entre 6 meses y 2-3 años.
- RT externa + braquiterapia: como hemos visto antes la braquiterapia consiste en administrar una fuente radiactiva dentro de la próstata guiada por ecografía. Su utilidad en tumores localmente avanzados es en combinación con RT externa. Esta opción tiene un tiempo de duración de 4-5 semanas frente a las 8 de la RT externa pero no es recomendable en caso de síntomas urinarios muy pronunciados.
Supresión androgénica
Como hemos dicho anteriormente la supresión androgénica consiste en aplicar tratamientos que consigan disminuir los niveles de testosterona en el organismo, con ello se ha observado que disminuye el tamaño tanto de la próstata normal como de la próstata tumoral. También es un tratamiento que actúa contra las células tumorales que han salido fuera de la próstata produciendo metástasis.
Se puede conseguir reducir al máximo los niveles de testosterona de varias maneras:
- Mediante una cirugía denominada orquiectomía que consiste en extirpar los testículos (donde está la mayor fuente de andrógenos del cuerpo).
- Mediante fármacos que actúan sobre la hormona que regula la cantidad de andrógenos que producen los testículos. Los más empleados son: goserelina, leuprorelina, triptorelina, buserelina. Todos ellos se administran mediante inyección.
- Mediante fármacos denominados antiandrógenos: actúan sobre los receptores de andrógenos. Los más utilizados son flutamida y bicalutamida que son fármacos de administración oral. Estos fármacos por sí solos no disminuyen suficientemente los niveles de testosterona y en general, deben ser empleados en combinación con los anteriores.
En pacientes con cáncer de próstata localmente avanzado la deprivación androgénica rara vez se utiliza como única estrategia, puesto que no obtiene los mismos resultados que la cirugía o la RT en cuanto a control local del tumor.
Efectos secundarios del tratamiento hormonal: disminución del deseo sexual, impotencia, sofocos, crecimiento del tejido mamario que puede ser doloroso, debilidad muscular, pérdida de masa ósea con riesgo aumentado de fracturas y un mayor riesgo de desarrollar diabetes o enfermedad coronaria.
Tratamientos de pacientes con elevación del PSA tras la terapia local
Cuando en el seguimiento de pacientes tratados de cáncer de próstata localizado y en fase precoz se detecta una elevación mantenida de los niveles de PSA en sangre en ausencia de síntomas, a menudo con los métodos diagnósticos disponibles no podemos detectar metástasis. Entonces hablamos de recidiva bioquímica. En estos casos es fundamental estadiar bien la situación del tumor, con exploraciones complementarias como el TAC abdominal, la gammagrafía ósea, el PET-colina o el PET-PSMA, Esta situación representa una categoría del cáncer de próstata avanzado en la que hemos de tener en cuenta ciertas consideraciones:
- Algunos de estos pacientes todavía pueden ser curables con una terapia local adicional.
- El tiempo medio que tarda el tumor en dar signos de enfermedad diseminada (como son las metástasis óseas) es hasta de ocho años y en algunas ocasiones no hay nunca progresión sintomática.
Sin embargo, muchos pacientes, aunque están asintomáticos, presentan grandes niveles de ansiedad al ver que los niveles de PSA aumentan progresivamente.
El mejor tratamiento en esta situación depende de varios factores:
- En pacientes que han sido tratados previamente con RT se puede plantear una prostatectomía de rescate si la recaída se limita a la próstata y el crecimiento tumoral no es rápido. El tiempo que tardan los niveles de PSA en multiplicarse x 2 se denomina tiempo de doblamiento del PSA y nos da una idea del crecimiento tumoral. Pues bien, cuando este tiempo de doblamiento es inferior a 3 meses, debemos considerar otras opciones distintas a la cirugía.
- Pacientes tratados inicialmente con cirugía radical pueden ser rescatados de forma exitosa con RT. Sin embargo, el tratamiento local no es el recomendado en la mayoría de los casos debido a la alta probabilidad de que el tumor se haya extendido más allá de la próstata, aunque no podamos detectarlo con los métodos diagnósticos disponibles. En este sentido, el PET-colina puede ser de utilidad en un intento de localizar el foco de recidiva.
- Para pacientes no candidatos a cirugía o RT nos quedan dos opciones: terapia hormonal (basado en deprivación androgénica) o bien observación.
¿Cuándo iniciar el tratamiento hormonal en recidiva bioquímica sin síntomas?
Las razones a favor de iniciar un tratamiento precoz en ausencia de síntomas serían:
- Retrasar la progresión de la enfermedad y disminuir la tasa de complicaciones tales como la obstrucción urinaria y las metástasis dolorosas.
- Podría haber un beneficio en supervivencia, sobre todo en pacientes con enfermedad mínima. No demostrado en estudios hasta la fecha.
- Muchos pacientes no aceptan diferir el tratamiento mientras los niveles de PSA siguen aumentando en cada determinación.
Las razones a favor de esperar e iniciar tratamiento cuando existan signos de la enfermedad son:
- Los efectos secundarios indeseables que merman claramente la calidad de vida del paciente y su entorno familiar.
- El elevado coste del tratamiento.
El paciente debe ser informado del beneficio / riesgo de ambas opciones y participar con su especialista en la decisión a tomar, y de manera ideal, tras presentar su caso en un comité uro-oncológico con expertos en cáncer de próstata, tanto urólogos, como oncólogos médicos y oncólogos radioterapeutas.
Cáncer de próstata metastásico
Tratamiento de primera línea
Una parte de los pacientes con cáncer de próstata recaen en forma de enfermedad avanzada después del tratamiento local (radioterapia o prostatectomía radical) y, por otra parte, existe una minoría de pacientes que presentan enfermedad diseminada o extendida ya desde el diagnóstico.
Cuando el cáncer se ha extendido más allá de la glándula prostática la supresión androgénica es la estrategia de tratamiento usualmente recomendada.
Existen varias opciones disponibles para conseguir disminuir o eliminar los niveles de andrógenos:
- Orquiectomía: cirugía que consiste en extirpar los testículos (donde está la mayor fuente de andrógenos del cuerpo).
- Inyecciones de agonistas de la LHRH: son fármacos que actúan sobre la hormona que regula la cantidad de andrógenos que producen los testículos. Los más empleados son: goserelina (Zoladex®), triptorelina (Decapeptyl®), buserelina (Suprefact®), leuprorelina (Procrin®, Eligard®). Se administran mediante inyección mensual, trimestral o incluso semestral.
- Bloqueo androgénico completo: combinación de agonistas LHRH con antiandrógenos que actúan sobre los receptores de andrógenos, los más usados son bicalutamida (Casodex®) y flutamida (Eulexin®). Esta opción conlleva mayores efectos secundarios indeseables, además de ser más costosa. Por otro lado, consigue un modesto beneficio en supervivencia (1-5% a los 5 años).
El tratamiento en monoterapia con andrógenos se asocia con una menor tasa de disfunción sexual y también produce menos pérdida de masa ósea. Sin embargo, no puede ser considerada una forma de tratamiento estándar para el cáncer de próstata y su uso debería estar restringido a casos muy seleccionados como tumores de bajo grado o bien enfermedad metastásica de poco volumen.
El bloqueo hormonal intermitente se ha estudiado como alternativa para mejorar la calidad de vida de los pacientes que precisan tratamiento hormonal. Consiste en retirar el tratamiento durante un periodo de tiempo, permitiendo así que el paciente recupere la función sexual, al menos temporalmente. Normalmente se retira el tratamiento una vez conseguida la máxima respuesta y se reinicia de nuevo cuando los niveles de PSA se elevan por encima de un determinado nivel (10-20 ng/ml). Sin embargo, hay un estudio que sugiere que esta estrategia es discretamente inferior al bloque continuo.
Dos grandes estudios comunicados recientemente refrendan el papel de la quimioterapia con docetaxel asociada a la terapia de supresión androgénica. Ambos estudios concluyen que los pacientes con cáncer de próstata metastásico que reciben 6 ciclos de docetaxel en régimen trisemanal, además de la terapia con análogos LHRH, consiguen supervivencias entre 10 y 17 meses superiores con un buen perfil de tolerancia, una magnitud de beneficio que no se había observado hasta la fecha en ningún tumor sólido con la adición de un agente quimioterápico. Por tanto, la quimioterapia con docetaxel debe recomendarse a los pacientes con cáncer de próstata metastásico asociada al tratamiento inicial con análogos LHRH, especialmente a los pacientes con enfermedad metastásica de inicio “de novo”, con gran volumen tumoral (más de 4 focos de metástasis óseas o presencia de metástasis en pulmón o hígado) y siempre que tengan buen estado general y no presenten contraindicaciones para la misma.
La mayoría de los pacientes responden a una primera maniobra hormonal, pero también prácticamente todos progresan al tratamiento, sobre todo dentro de los primeros dos años. En esta etapa, son considerados tumores resistentes a la castración, es decir, la supresión androgénica sola es ineficaz como tratamiento. Sin embargo, los pacientes pueden responder a otros agentes hormonales.
Tratamiento de segunda línea
Prácticamente todos los pacientes con cáncer de próstata avanzado desarrollan tarde o temprano resistencia al tratamiento hormonal de supresión androgénica, evolucionando pues, hacia el estado de cáncer de próstata resistente a la castración (CPRC) definido como el cáncer que progresa a pesar de mantener niveles de testosterona en sangre en rango de castración (<50 mg/dl). Estos pacientes son candidatos a recibir tratamiento sistémico de rescate y son varias las opciones disponibles hoy en día: nuevos fármacos hormonales, quimioterapia o agentes dirigidos al hueso.
Tratamientos con inhibidores del receptor androgénico
El acetato de abiraterona es un fármaco de administración oral que impide la síntesis de andrógenos tanto a nivel de los testículos, como de la glándula suprarrenal, como del propio tumor de próstata y ha sido ampliamente investigado en el tratamiento del cáncer de próstata en diferentes estadios.
En un estudio aleatorizado, más de 1.000 pacientes con cáncer de próstata resistente a la castración metastásico (CPRCm), en tratamiento previo con uno o dos regímenes de quimioterapia, al menos uno de ellos con docetaxel, los pacientes tratados con acetato de abiraterona combinada con una dosis de prednisona o prednisolona presentaron una mejoría importante en la supervivencia global frente a los pacientes tratados con prednisona o prednisolona más placebo. El tratamiento con acetato de abiraterona consiguió una reducción de un 35% en el riesgo de muerte y un aumento en la supervivencia media (14,8 meses frente a 10,9 meses) en comparación con el tratamiento basado en placebo.
Datos recientemente publicados confirman también el beneficio en supervivencia global de abiraterona en combinación con prednisona en pacientes con cáncer de próstata resistente a castración metastásico asintomáticos o con mínimos síntomas que no han recibido previamente quimioterapia con docetaxel, además de conseguir una ventaja en la supervivencia sin progresión radiológica, un retraso en la necesidad de quimioterapia o en la necesidad de analgésicos opiáceos.
Abiraterona tiene un buen perfil de tolerancia, destacando como efectos más frecuentes la retención de líquidos, la hipertensión arterial y la disminución de niveles de potasio en sangre; como efectos menos frecuentes el fármaco puede elevar las enzimas hepáticas en la analítica y podría provocar daño cardiaco en una minoría de pacientes.
En nuestro país, la abiraterona en combinación con prednisona está indicado y comercializado para el tratamiento del cáncer de próstata resistente a castración metastásico de pacientes que han progresado al tratamiento con docetaxel y de pacientes que no han recibido quimioterapia previa, siempre que estén asintomáticos o con poco dolor.
Enzalutamida es un nuevo fármaco del grupo de los antiandrógenos mucho más potente y eficaz que bicalutamida, también de administración oral, que a diferencia de abiraterona, no necesita la administración concomitante de prednisona.
Un estudio fase III multicéntrico internacional aleatorizó algo más de 1.000 pacientes con CPRC metastásico que habían progresado al tratamiento previo con docetaxel, a recibir enzalutamida o bien placebo, los pacientes tratados con el fármaco tuvieron una supervivencia media de 18,4 meses comparado con 13,6 meses para los tratados con placebo. Esto se traduce en una reducción del 37% en el riesgo de muerte.
Recientemente se han comunicado los datos actualizados de supervivencia de enzalutamida frente a placebo en pacientes con CPRC metastásicos asintomáticos o con pocos síntomas que no han sido tratados con quimioterapia previa, confirmando un beneficio en la supervivencia global, en la supervivencia sin progresión y en el tiempo hasta la necesidad de quimioterapia.
Enzalutamida tiene también un buen perfil de tolerancia, destacando como efectos más frecuentes el cansancio, la diarrea que suele ser leve e intermitente, el dolor muscular, la cefalea y la hipertensión arterial.
Enzalutamida está indicado y comercializado para el tratamiento del cáncer de próstata resistente a castración metastásico de pacientes que han progresado al tratamiento con docetaxel y de pacientes que no han recibido quimioterapia previa, siempre que estén asintomáticos o con poco dolor, incluso en pacientes que presentan metástasis viscerales (hígado o pulmón).
Tanto abiraterona como enzalutamida presentan interacciones con otros fármacos a tener en cuenta y dado que la indicación de ambos fármacos es para enfermedad metástasica, es muy importante monitorizar la presencia de síntomas asociados a la enfermedad, especialmente la progresión de dolor. A pesar del buen perfil de tolerancia, los pacientes que reciben estos tratamientos deben realizar controles estrechos por su especialista.
Quimioterapia
La quimioterapia ya se mostró en los años 90 efectiva como tratamiento paliativo del cáncer de próstata. Las diversas combinaciones de fármacos citotóxicos estudiadas conseguían una respuesta biológica (reducción del PSA) en más del 50% de los pacientes, con una duración de la respuesta de alrededor de 6 meses.
Dos estudios aleatorizados a finales de los 90 demostraron beneficio clínico con un esquema que combinaba dos fármacos: mitoxantrone y prednisona comparado con prednisona solo, pero sin mejorar la supervivencia. En el año 2004, se publicaron los resultados de dos estudios aleatorizados que por primera vez demostraron beneficio en la supervivencia global con esquemas de quimioterapia que contienen docetaxel frente al esquema clásico de mitoxantrone-prednisona (considerado estándar hasta esa fecha).
En ambos estudios, la supervivencia alcanzada para los pacientes tratados con docetaxel alcanza los 17-18 meses, además docetaxel reduce un 20-24% el riesgo de muerte, aumenta significativamente la respuesta de PSA, mejora significativamente el dolor y la calidad de vida de los pacientes. El efecto secundario más importante que provoca docetaxel es el descenso en el recuento de glóbulos blancos que es causa de mayor susceptibilidad a las infecciones, otros efectos adversos que ocasiona son: caída del cabello, náuseas, diarrea, retención de líquidos, alteraciones en las uñas, fatiga y debilidad, entre otros.
La combinación docetaxel-prednisona ha sido considerada hasta hoy en día tratamiento estándar del cáncer de próstata resistente a castración metastásico.
Hasta el año 2010 no existía ningún tratamiento con eficacia demostrada en estudios clínicos controlados para los pacientes en los que docetaxel había fracasado, la combinación mitoxantrone-prednisona era la más utilizada hasta hace unos años en este grupo de pacientes (en segunda línea de tratamiento).
Un estudio publicado en 2010 demuestra que un nuevo agente quimioterápico del grupo de los taxanos llamado cabazitaxel combinado con prednisona, consigue una mejoría estadísticamente significativa en supervivencia global frente al esquema clásico de mitoxantrone-prednisona (15.1 meses frente a 12.7 meses). Los efectos secundarios más frecuentes de este nuevo tratamiento fueron la diarrea y el descenso en el recuento de glóbulos blancos que provoca mayor susceptibilidad a las infecciones. Con estos resultados, este fármaco fue el primero que se aprobó en nuestro país para la indicación de tratamiento del cáncer de próstata resistente a castración que ha progresado a quimioterapia con docetaxel.
Tratamientos dirigidos al hueso
Radio-223 es un nuevo agente del grupo de los radiofármacos que debe administrarse en el Servicio de Medicina Nuclear. El fármaco ha demostrado mejorar la supervivencia frente a placebo (14.9 vs 11.3 meses) en pacientes sintomáticos con carcinoma prostático avanzado con metástasis óseas que ya habían recibido previamente quimioterapia con docetaxel o bien que no eran elegibles para dicho tratamiento. Radio-223 consiguió una reducción del riesgo de muerte del 31%. Además de este beneficio en supervivencia, la administración del fármaco prolongó el tiempo hasta el primer evento óseo y no añadió toxicidad reseñable en comparación con placebo. Se administra de forma intravenosa en 6 dosis con un intervalo mensual entre dosis. Recientemente, el Radio-223 ha obtenido la indicación en España de tratamiento para el cáncer de próstata resistente a la castración con metástasis óseas sintomáticas en pacientes que no presentan metástasis viscerales.
Tratamientos que mejoran la calidad de vida
Existen otras opciones de tratamiento disponibles que mejoran los síntomas asociados a la enfermedad y deben ser aplicados en combinación con los tratamientos específicos del tumor (hormonoterapia y quimioterapia) para mejorar la calidad de vida de los pacientes.
Los medicamentos contra el dolor o analgésicos (desde aspirina hasta los opioides) son muy eficaces. En cuanto a la posible adicción o dependencia con fármacos opioides casi nunca es un problema si se prescriben en pacientes con dolor de gran intensidad. Son efectos secundarios indeseables de los mismos la somnolencia y el estreñimiento, pero habitualmente se pueden manejar ajustando las dosis o agregando otros medicamentos para aliviar estos efectos.
Los bifosfonatos son un grupo de medicamentos que puede ayudar a aliviar el dolor de huesos causado cuando el cáncer que se ha extendido (metástasis óseas). Además, los bifosfonatos ayudan a fortalecer los huesos en los pacientes que reciben terapia hormonal (prevención de la osteoporosis) y también son eficaces en la prevención de complicaciones esqueléticas (dolor, fracturas patológicas, compresión de la médula espinal y necesidad de cirugía o radioterapia sobre el hueso) en pacientes con cáncer de próstata resistente a castración con metástasis óseas.
El bifosfonato más usado es el ácido zoledrónico, que se administra mediante inyección intravenosa de corta duración (15 minutos) ajustando la dosis a la función renal del paciente.
Los bifosfonatos pueden ocasionar efectos secundarios, incluyendo síntomas parecidos a la gripe, dolor en los huesos 24 horas tras la infusión y un efecto secundario poco común, pero muy molesto, es la osteonecrosis del hueso mandibular (se detiene el riego sanguíneo de un área en el hueso y esa parte del hueso muere). Esto puede causar pérdida de dientes e infecciones o heridas abiertas del hueso de la mandíbula que no cicatrizan. La única manera eficaz de tratar esta complicación es suspender la administración del medicamento y administrar fármacos para aliviar los síntomas. Se presenta más a menudo después de realizar manipulación dental como extracción de un diente o muela mientras el paciente recibe tratamiento con bisfosfonatos.
Denosumab es un anticuerpo monoclonal dirigido frente a una proteína clave en la progresión de las metástasis óseas; se administra vía subcutánea una vez al mes y tiene un efecto en la prevención de eventos esqueléticos (fracturas patológicas, radioterapia o cirugía sobre el hueso y compresión medular) asociados a las metástasis óseas de diferentes tumores sólidos, entre los que se encuentra el cáncer de próstata resistente a castración.
En un estudio aleatorizado, denosumab comparado con ácido zoledrónico retrasó significativamente la aparición del primer acontecimiento óseo y redujo tanto el primer evento como los siguientes.
Tanto denosumab como ácido zoledrónico están indicados en el tratamiento del cáncer de próstata resistente a castración con metástasis óseas para prevenir los eventos óseos asociados a la enfermedad metastásica; ninguno de los dos fármacos ha demostrado incrementar la supervivencia de los pacientes, sin embargo, sí contribuyen a mejorar la calidad de vida. No existe evidencia científica que justifique la utilización periódica mensual de ácido zoledrónico en pacientes con cáncer de próstata avanzado en fase hormonosensible y parece que su uso prolongado (más allá de dos años) aumenta las posibilidades de padecer una osteonecrosis mandibular.
Denosumab es superior a ácido zoledrónico en la prevención de eventos óseos con la ventaja de que no necesita ajustar la dosis a la función renal del paciente, aunque la tasa de osteonecrosis mandibular que provoca es discretamente superior a la del ácido zoledrónico y con un mayor coste económico.
Prevención de la osteonecrosis mandibular: revisión dental y tratar cualquier problema que se detecte antes de comenzar el tratamiento. Mantener una buena higiene oral y someterse a exámenes dentales regularmente.
Cáncer renal
El cáncer de células renales (también llamado cáncer de riñón) es una enfermedad en la que se encuentran células malignas o cancerosas que se originan en el revestimiento de los túbulos del riñón (en la corteza renal).
El cáncer de células renales es responsable de un 2-3% de todos los tumores malignos en el adulto. Es dos veces más frecuente en hombres que en mujeres. Es más frecuente en afroamericanos que en raza caucasiana. La mayoría de los casos se diagnostica entre la 4ª y la 6ª década de la vida (a partir de los 50 años de edad), pero se puede presentar a cualquier edad.
Factores de riesgo
El cáncer de células renales se presenta más frecuentemente de forma esporádica (sin antecedentes familiares) y raras veces forma parte de un síndrome hereditario (5% de los casos).
No se han determinado las causas exactas de esta enfermedad, sin embargo, el hábito tabáquico (dobla el riesgo de desarrollar esta enfermedad), la exposición a ciertos productos químicos (cadmio, asbestos, petróleo) la obesidad, la enfermedad quística renal adquirida en pacientes sometidos a diálisis crónica (30% de estos pacientes desarrollarán un cáncer renal) y el uso indiscriminado de analgésicos (aspirina y fenacetina, en este caso más implicados en el desarrollo de cáncer de vías urinarias), se asocian con un incremento en la incidencia de esta enfermedad.
Existen varios síndromes hereditarios que asocian cáncer renal de distintos tipos histológicos con otro tipo de tumores. En general, aquellos pacientes con un familiar de primer grado diagnosticado de cáncer renal antes de los 40 años y los que presentan cáncer renal bilateral o multifocal en un mismo riñón pueden tener un componente hereditario. Hay que recordar que tan sólo un 5% de los tumores renales que se diagnostican forman parte de un síndrome hereditario, la inmensa mayoría son esporádicos.
Clasificación
El carcinoma de células renales representa un 80-85% de todos los tumores malignos renales. Típicamente se origina en la corteza renal y presenta varios subtipos. Aquí describimos los subtipos más frecuentes o relevantes:
- Carcinoma de células claras (80%) es el más frecuente. Las células claras pueden tener un crecimiento que varía de lento (grado 1) hasta rápido (grado 4). En este tipo de cáncer renal se han validado los resultados de la terapia dirigida y la inmunoterapia.
- Carcinoma papilar (15%). Se divide en dos subclases: tipo 1 y tipo 2 (este último de comportamiento más agresivo), se tratan actualmente de la misma manera que el carcinoma de riñón de células claras.
- Carcinoma cromófobo y oncocitoma (5%), este último es de crecimiento muy lento y rara vez tiene capacidad para diseminarse.
- Carcinoma de los conductos colectores (<1%), se comporta de modo similar al carcinoma de células transicionales de vejiga y vías urinarias.
- Variante sarcomatoide: puede coexistir con cualquiera de los subtipos anteriores y conlleva un comportamiento más agresivo del tumor por su crecimiento local más rápido e invasivo. Se llama sarcomatoide porque al examinarlo con el microscopio se asemeja al sarcoma.
El nefroblastoma o tumor de Wilms es otro tipo de cáncer renal que se presenta típicamente en la infancia.
El angiomiolipoma es un tumor benigno que tiene un aspecto característico en la tomografía computarizada (TAC). Tiende a crecer y no suele diseminarse, se puede manejar de forma conservadora, embolización o con cirugía parcial renal.
Sintomatología
El cáncer renal es fundamentalmente asintomático, por lo que suele ser un hallazgo casual al realizar pruebas (ecografías o TAC) por otros motivos. Muchos pacientes no experimentan síntoma alguno hasta que la enfermedad se ha extendido a otros órganos. . Se ha descrito como típica la asociación de hematuria (sangre en la orina), masa y dolor en costado, pero esta triple asociación tan solo está presente en un 10% de los casos. La hematuria aparece en más de la mitad de los casos, pero puede no ser visible y tan sólo evidenciarse en un análisis de orina (hematuria microscópica).
La anemia, fiebre y pérdida de peso son relativamente frecuentes en este tipo de tumores, cuando están en situaciones avanzadas de la enfermedad.
Menos frecuentes son la policitemia (aumento en la cifra de hemoglobina) y la hipercalcemia (esta última debe obligarnos a descartar una extensión del tumor a los huesos).
Diagnóstico
Para el diagnóstico se realiza una evaluación completa del enfermo, auxiliándonos en pruebas complementarias.
- Exploración física y antecedentes: es importante siempre explorar al paciente para verificar el estado general de salud e identificar cualquier signo de enfermedad, como masas, bultos o cualquier otro signo que parezca inusual. También se interroga al paciente sobre sus hábitos, antecedentes de enfermedades y tratamientos recibidos. Es importante investigar también antecedentes de cáncer en la familia.
- Analítica de sangre: se solicitan varios perfiles analíticos que orientan acerca del estado global de salud y actividad de la enfermedad.
- Analítica de orina: prueba para determinar el contenido en azúcar, proteínas, la presencia o no de sangre y bacterias.
- Ecografía abdominal: útil para identificar masas renales y distinguir si son de naturaleza quística o sólidas.
- Tomografía con contraste (TAC): es el procedimiento de elección; se trata de un procedimiento mediante el cual se hacen una serie de imágenes detalladas del interior del cuerpo, desde ángulos diferentes. Es útil para detectar y evaluar masas renales, si existe infiltración de la vena cava inferior, así como si existe extensión a los ganglios linfáticos regionales.
- Resonancia magnética (RMN): en el caso de que exista sospecha de trombosis o infiltración de la vena cava inferior, esta técnica nos puede ayudar a evaluar la extensión de dicha infiltración.
- Arteriografía renal: menos utilizada hoy en día con el advenimiento de otras técnicas como la resonancia; útil para definir la vascularización del tumor renal y por lo tanto en la evaluación previa a la cirugía.
- Gammagrafía ósea (GGO): para descartar extensión a los huesos en caso de sospecha clínica por dolor o elevación de la fosfatasa alcalina o de los niveles de calcio en la analítica.
- Biopsia o punción-aspiración con aguja fina (PAAF): extracción de células o tejidos realizada para que un patólogo los observe bajo un microscopio y determine la presencia o no de células tumorales. Para llevar a cabo una biopsia del cáncer de células renales, se inserta una aguja delgada en el tumor y se extrae una muestra de tejido.
- PET-TAC: con la tecnología más reciente se pueden hacer una PET y una TAC al mismo tiempo (PET/CT scan). Esto le permite al radiólogo localizar con mayor precisión anatómica las áreas de mayor captación (que sugieren un área de cáncer) en el PET, aunque no se trata de una técnica estándar y sólo debe usarse en casos seleccionados. Su utilidad es mayor en otros tipos de cánceres.
Estadificación
Para la estadificación se utiliza el sistema TNM. En resumen, los estadios clínicos basados en este sistema son:
- Estadio I: el tumor mide 7 centímetros o menos y se encuentra limitado al riñón.
- Estadio II: el tumor mide más de 7 centímetros y se encuentra limitado al riñón.
- Estadio III: el tumor invade la glándula suprarrenal situada justo encima del riñón o la capa de tejido graso que rodea al riñón o los vasos sanguíneos principales del riñón (como la vena cava) y puede invadir los ganglios linfáticos abdominales.
- Estadio IV: el cáncer se ha extendido a otros órganos como los intestinos, el páncreas, los pulmones, el hígado o los huesos, provocando metástasis a distancia.
Pronóstico
La historia natural del cáncer de células renales es muy variable, y depende de en qué momento se ha hecho el diagnóstico. Aproximadamente un 30% de los pacientes se presentarán como enfermedad diseminada o metastásica en el momento del diagnóstico y un tercio de los restantes desarrollarán metástasis a lo largo de su evolución.
El pronóstico y las opciones de tratamiento dependen básicamente de dos factores:
- El estadio de la enfermedad: a medida que avanza el estadio (de I a IV), menores son las posibilidades de curación.
- La edad del paciente y su estado general de salud.
En la enfermedad avanzada o metastásica los niveles de hemoglobina, neutrófilos, plaquetas y calcio en sangre, conjuntamente con el estado general y el tiempo transcurrido desde el diagnóstico, son factores que clasifican a los pacientes en tres grupos de riesgo pronóstico (criterios de Motzer):– —
– Grupo de buen pronóstico. – Grupo pronóstico intermedio. – Grupo de mal pronóstico.
Tratamiento
Hay distintos tipos de tratamiento disponibles para los pacientes con cáncer de células renales.
Algunos tratamientos son estándar (el tratamiento de uso actual), y otros se están probando en ensayos clínicos. Un ensayo clínico de tratamiento es un estudio dirigido a ayudar a mejorar los resultados de los tratamientos actuales o de obtener información sobre nuevos tratamientos para los pacientes con cáncer.
Cuando los ensayos clínicos muestran que un tratamiento nuevo es mejor que el tratamiento estándar, el nuevo tratamiento se puede convertir en el tratamiento estándar.
| Estadío | Tratamiento |
| Estadios I y II | Nefrectomía radical o parcial con o sin linfadenectomía Crioablación o ablación por radiofrecuencia |
| Estadio III | Nefrectomía radical con linfadenectomía regional |
| Estadio IV | Nefrectomía citorreductora Resección de metástasis Tratamientos sistémicos: • Inmunoterapia • Antiangiogénicos • Inhibidores mTOR • Quimioterapia Radioterapia paliativa Bifosfonatos |
Cirugía
Cuando la enfermedad se presenta localizada al riñón la cirugía puede ser potencialmente curativa y en principio debe ofrecerse a los pacientes con estadios I, II o III.
Para tratar el cáncer de células renales puede utilizarse una intervención quirúrgica que extirpa parte del riñón o todo el riñón. Existen los siguientes tipos de cirugía:
- Nefrectomía radical: procedimiento quirúrgico que extrae el riñón, la glándula suprarrenal (actualmente sólo se extirpa en caso de sospecha de infiltración), el tejido de alrededor y, por lo general, algunos ganglios linfáticos cercanos. A veces deben resecarse también parte de órganos adyacentes en caso de que el tumor esté adherido. Normalmente se realiza mediante laparoscopia, cirugía robótica o por cirugía abierta. Es potencialmente curativa
- Nefrectomía parcial: procedimiento quirúrgico para extraer el tumor y parte del tejido que lo rodea con el fin de conservar tejido renal sano y funcionante. Se puede realizar una nefrectomía parcial para evitar la pérdida de la función renal cuando el otro riñón está dañado o ya se ha extirpado, también en caso de tumores bilaterales y debe ser considerada la técnica de elección cuando el tumor es menor de 7 cm, ya que conserva mejor la función renal. La nefrectomía parcial puede realizarse por vía laparoscópica y robótica. En casos muy contados sería necesario recurrir a la cirugía abierta.
Una persona puede vivir con sólo una parte de un riñón que funcione, pero si se extirpan los dos riñones o si no están funcionando, la persona necesitará diálisis (procedimiento para limpiar la sangre mediante una máquina exterior al cuerpo) o un trasplante de riñón (sustituir el riñón enfermo por un riñón sano donado).
La crioablación y la ablación por radiofrecuencia: son otras alternativas para el tratamiento local del tumor en caso de no ser viable la nefrectomía parcial por varias razones (condición médica del paciente). El objetivo es destruir el tumor mediante congelación (crioablación) o mediante alta energía (radiofrecuencia). Son útiles sólo en caso de tumores de pequeño tamaño, y pacientes con importantes comorbilidades que impiden realizar el procedimiento quirúrgico.
Cirugía en cáncer renal avanzado (estadio IV): la opción de cirugía para pacientes con enfermedad diseminada o extendida tiene como objeto reducir el mayor volumen de masa tumoral posible (cirugía citorreductora) y es útil en algunos pacientes que son candidatos a recibir posteriormente tratamiento con inmunoterapia o con terapia dirigida, sobretodo en aquellos considerados como grupo de buen pronóstico y de pronóstico intermedio. . No es una opción válida para pacientes con múltiples localizaciones metastásicas y mal estado general.
Cirugía de metástasis: la cirugía de metástasis puede ser útil en casos muy seleccionados, especialmente en metástasis pulmonares de poco volumen y de pequeño tamaño, o también en el caso de metástasis suprarrenales.
Cirugía renal mínimamente invasiva (Laparoscopia, retroperitoneoscopia y robótica)
Con la intención de minimizar la agresión quirúrgica y de mejorar la recuperación post-quirúrgica, nacieron las técnicas de nefrectomía total o parcial laparoscópica y robótica para el tratamiento del cáncer renal.
La nefrectomía parcial laparoscópica y la nefrectomía parcial robótica Da Vinci han demostrado menor sangrado intraoperatorio, mejor recuperación de la función renal, menor ingreso hospitalario y más rápida recuperación y reinicio de vida laboral.
En casos de que existan cirugías abdominales previa o en casos de que el tumor esté situado en la cara posterior del riñón, la técnica de elección es la nefrectomía parcial por Retroperitoneoscopia, es decir, accediendo al riñón desde la espalda y el costado, no desde el abdomen. En estos casos, la recuperación es muy rápida, disminuye el sangrado y el tiempo operatorio, así como la estancia hospitalaria
Radioterapia
En cáncer renal, la radioterapia sobre el tumor primario se considera una opción de tratamiento paliativa, es decir, no curativa y se puede considerar en algunos casos con enfermedad localizada al riñón y condiciones médicas desfavorables para someterse a una cirugía. En caso de afectación de los márgenes de resección quirúrgicos se podría utilizar como tratamiento complementario a la cirugía, aunque esta estrategia no parece claramente demostrada en los estudios clínicos.
Por lo tanto, en el cáncer renal, el papel de la radioterapia queda reservado a paliar síntomas derivados de las metástasis óseas.
Tratamiento médico
Cuando se trata de un cáncer renal avanzado, la cirugía no es curativa y por lo tanto se recomienda un tratamiento con fármacos que actúen globalmente y lleguen a todos los órganos del cuerpo (tratamiento sistémico) con la finalidad de conseguir remisión de la enfermedad o impedir la progresión de la misma. El cáncer de células renales recidivado es un cáncer que ha reaparecido después de haber sido tratado y puede reaparecer en el riñón o en otras partes del cuerpo, incluso años después del tratamiento inicial. En aquellos casos en los que la enfermedad recae o bien progresa tras la cirugía, debemos proponer también un tratamiento sistémico. En casos seleccionados de recaída única se puede considerar la cirugía de rescate si es factible.
En el tratamiento previo a la cirugía o complementario tras ella no debe considerarse un tratamiento sistémico a fecha de hoy, de forma estandarizada.
Quimioterapia
En general, el cáncer de células renales, a diferencia de otro tipo de tumores, es resistente a quimioterapia. Por lo tanto, necesitamos otras estrategias terapéuticas.
Inmunoterapia y tratamiento inhibidor de “check-point” celular
Es un tipo de terapia biológica que estimula la capacidad del sistema inmune para combatir el cáncer. Se emplean sustancias producidas por el cuerpo o fármacos elaborados en un laboratorio para estimular, dirigir o restaurar las defensas naturales del cuerpo contra la enfermedad.
Varias estrategias basadas en inmunoterapia se han utilizado para aumentar la inmunidad antitumoral. La administración de citoquinas clásicas como Interleukina 2 (IL-2) e Interferón α (IFNα), tiene eficacia clínica demostrada desde la década de los 80, sin embargo hoy en día su uso en la clínica ha disminuido considerablemente debido a la eficacia de nuevos tratamientos diana que han demostrado mayor eficacia clínica y mejor perfil de tolerancia.
Por otro lado, han aparecido nuevos fármacos basados en inhibidores de receptores celulares “check-point” como son PDL-1 (programmed death 1 checkpoint) y CTLA-4. Estos fármacos son Nivolumab, Ipilimumab, Pembrolizumab, Avelumab. Cuando se bloquean estos receptores, conseguimos una respuesta inmunitaria mantenida contra las células tumorales
Terapia dirigida
La terapia dirigida utiliza fármacos y otras sustancias que pueden identificar y eliminar células cancerosas específicas sin dañar las células normales. Son los fármacos denominados terapias diana. Estos fármacos pueden producir remisión de la enfermedad o bien impedir la progresión de la misma en la mayoría de los casos pero no curan la enfermedad.
La terapia antiangiogénica es un tipo de terapia dirigida para el cáncer avanzado de células renales con resultados muy consolidados en los últimos años. Actúa sobre receptores críticos de los vasos sanguíneos desarrollados en el propio tumor. Con este tipo de terapia se impide la formación de nuevos vasos sanguíneos por parte del tumor que son imprescindibles para que éste se nutra y así seguir avanzando; el resultado es que el tumor deja de crecer o reduce su tamaño.
Entre los fármacos antiangiogénicos, los mejores resultados se han conseguido con Sunitinib, Pazopanib, Tivozanib, Bevacizumab, Sorafenib, Axitinib y recientemente Cabozantinib.
Los denominados inhibidores de la vía mTOR que es una vía que tiene un papel fundamental en el metabolismo, crecimiento, y proliferación de la célula tumoral, han demostrado actividad en esta enfermedad en estudios aleatorizados y actualmente disponemos de dos fármacos: Temsirolimus y Everolimus.
Estas combinaciones han demostrado eficacia en primera línea o en el tratamiento de entrada para la enfermedad avanzada:
- Axitinib-Avelumab
- Axitinib-Pembrolizumab
- Nivolumab-Ipilimumab
- Sunitinib
- Pazopanib
- Tivozanib
- Bevacizumab-interferon
- Temsirolimus en pacientes con criterios de mal pronóstico
En segunda línea o tras fallo al tratamiento de entrada:
- Nivolumab
- Cabozantinib
- Axitinib
- Everolimus
- Sorafenib
Existen otros fármacos como el Lenvatinib u otras combinaciones (Cabozantinib-Nivolumab,…) pendientes de llegar en los próximos años con resultados prometedores.
Tratamiento sintomático
Además del tratamiento específico de la enfermedad es importante el manejo de síntomas en cáncer renal. Para aliviar el dolor, además de fármacos analgésicos, es útil la radioterapia como tratamiento paliativo.
En el caso de las metástasis óseas también es útil la utilización de fármacos del grupo de los bifosfonatos (Zometa® -ácido zoledrónico-) que ayudan a disminuir las complicaciones derivadas de la afectación tumoral en el hueso.
Cáncer de vía urinaria superior: pelvis renal y uréter
El uréter es la estructura tubular delgada que conecta el riñón con la vejiga. La pelvis renal y los uréteres están revestidos de células de la capa transicional y a partir de estas células se genera la mayor parte de los cánceres de vía urinaria superior (75 al 85%).
Es importante recordar que el 90% de los tumores de células transicionales se sitúa en la vejiga. Únicamente el 5%-10% se localiza en el tracto urinario superior, por lo que también se denominan carcinoma urotelial de la vía urinaria superior. O tumor de vía urinaria. Los de la pelvis renal doblan en frecuencia a los presentados en el uréter.
Otros tipos histológicos son el carcinoma epidermoide (15 a 20%), que se asocia a litiasis urinarias e infecciones recurrentes, y el adenocarcinoma (6-8%).
Este cáncer es diferente al cáncer renal.
Los tumores primarios de la pelvis renal son relativamente poco frecuentes, constituyendo el 7-8% de todos los tumores renales en el ser humano. La mayor frecuencia ocurre entre la sexta y séptima décadas de la vida y pueden ser benignos, pero por lo general son malignos. Es más frecuente en hombres, en una proporción muy heterogénea según los estudios epidemiológicos que se han llevado a cabo: 1.7-4.2:1.
Factores de riesgo
Los factores de riesgo para el cáncer de células de transición de pelvis renal y de uréter son los siguientes:
- Tener antecedentes personales de cáncer de vejiga.
- Tabaquismo.
- Consumo crónico de analgésicos, como la fenacetina (paracetamol).
- Estar expuesto a ciertas tinturas y sustancias químicas utilizadas en la fabricación de productos de cuero, textiles, plásticos y caucho.
Sintomatología
Los síntomas más comunes son: hematuria (80-90%), dolor en flanco (24-37%) e irritación vesical (15-20%).
Vías de diseminación
El cáncer se puede diseminar por contigüidad, el sistema linfático y la sangre:
- Por contigüidad. El cáncer se extiende hacia las áreas cercanas, como a otras áreas del uréter, la vejiga, órganos adyacentes (glándulas suprarrenales, colon, intestino delgado) o la pared abdominal.
- Sistema linfático. Puede extenderse a través de los vasos linfáticos y llegar a los ganglios.
- Sangre. También puede diseminarse a través de los vasos sanguíneos y establecerse luego en cualquier órgano del cuerpo.
Diagnóstico
En el diagnóstico del cáncer transicional de pelvis renal y uréter se utilizan procedimientos no invasivos e invasivos:
- Examen físico y antecedentes de salud: se examina el estado general de salud y se identifica cualquier signo de enfermedad, como masas o cualquier otra cosa que parezca anormal. También se toman datos sobre los hábitos de salud, los antecedentes de enfermedades y los tratamientos anteriores
- Ureteroscopia: se observa el interior del uréter y la pelvis renal y sirve para detectar áreas sospechosas que requieren biopsia. Se introduce un ureteroscopio a través de la uretra para llegar hasta la vejiga, el uréter y la pelvis renal. A veces, se pasa un instrumento a través del ureteroscopio para tomar biopsias o muestras de tejido y analizarlas al microscopio en busca de signos de enfermedad.
- Citología de orina: prueba para comprobar las características celulares. A veces, se desprenden células cancerosas de los cánceres del riñón, vejiga o uréter que pasan a la orina. El rango de positividad para este tipo de tumores varía entre el 60 al 65% para los tumores de vía superior.
- Tomografía computarizada (TC): procedimiento para el que se toma una serie de imágenes detalladas del interior del cuerpo desde ángulos diferentes. Las imágenes se crean con una computadora conectada a una máquina de rayos X. Se inyecta un contraste yodado en una vena o se ingiere a fin de que los órganos o los tejidos se destaquen de forma más clara. Tiene un alto rendimiento diagnóstico que varía entre 78-92% para el cáncer de pelvis y uréter.
- Ecografía: procedimiento para el que se hacen rebotar ondas de sonido de alta energía (ultrasónicas) en los tejidos u órganos internos a fin de producir ecos. Los ecos forman una imagen de los tejidos del cuerpo que se llama ecograma. Se puede hacer una ecografía del abdomen para ayudar a diagnosticar el cáncer de pelvis renal y de uréter.
- Resonancia magnética (RM): procedimiento para el que usa un imán, ondas de radio y una computadora a fin de crear una serie de imágenes detalladas de áreas del interior del cuerpo, como la pelvis.
- Biopsia: extracción de células o tejidos para que un patólogo los observe al microscopio y determine si hay signos de cáncer. Este procedimiento se puede realizar durante una ureteroscopia o una cirugía.
Estadificación
Para la estadificación, aparte de los estudios diagnósticos ya mencionados, puede ordenarse:
- Tomografía por emisión de positrones (TEP): procedimiento para encontrar células de tumores malignos en el cuerpo. Se inyecta en una vena una cantidad pequeña de glucosa radiactiva (azúcar). El TEP rota alrededor del cuerpo y crea una imagen de los lugares del cuerpo que usan la glucosa. Las células de tumores malignos se ven más brillantes en la imagen porque son más activas y absorben más glucosa que las células normales. El rendimiento es bajo para este tipo de celularidad tumoral.
- Gammagrafía ósea: procedimiento para verificar si hay células en los huesos que se multiplican rápido, como las células cancerosas, en el hueso. Se inyecta una cantidad muy pequeña de material radiactivo en una vena y este recorre el torrente sanguíneo. El material radiactivo se acumula en los huesos con cáncer y se detecta con un escáner. Se realizan en aquellos casos en los que haya sospecha sintomática de metástasis ósea.
Con estas pruebas diagnósticas puede clasificarse la enfermedad dentro de un estadio determinado:
Estadio 0 (carcinoma papilar no invasor y carcinoma in situ): en este estadio se encuentran células anormales en el tejido que reviste el interior de la pelvis renal o el uréter. Es posible que estas células anormales se vuelvan cancerosas y se diseminen al tejido normal cercano. El estadio 0 se divide en los estadios 0a y 0is según el tipo de tumor:
- El estadio 0a también se llama carcinoma papilar no invasor, que a veces tiene el aspecto de bultos alargados y delgados que sobresalen del tejido que reviste el interior de la pelvis renal o el uréter.
- El estadio 0is también se llama carcinoma in situ; es un tumor plano en el tejido que reviste el interior de la pelvis renal o el uréter.
Estadio I: el cáncer se diseminó desde el tejido que reviste el interior de la pelvis renal o el uréter hasta la capa de tejido conjuntivo.
Estadio II: el cáncer se diseminó a la capa muscular de la pelvis renal o el uréter.
Estadio III: el cáncer se diseminó:
- desde la capa muscular de la pelvis renal a la grasa que rodea la pelvis renal o al tejido del riñón; o
- desde la capa muscular del uréter a la grasa que rodea el uréter.
Estadio IV: el cáncer se diseminó a por lo menos uno de los siguientes sitios:
- un órgano cercano.
- la capa de grasa que rodea el riñón.
- los ganglios linfáticos.
- a otras partes del cuerpo, como el pulmón, el hígado o el hueso.
Los estadios 0, I y II se presentan en la mayoría de los pacientes diagnosticados (55 a 65%) con una sobrevida a 5 años que va del 87 al 100%. Algunos investigadores encuentran que la supervivencia a 5 años para los estadios III y IV varía entre 12 a 50%.
Además, el cáncer de pelvis renal y de uréter puede clasificarse como localizado, regional, metastásico o recidivante:
- Localizado: el cáncer se encuentra solamente en el riñón.
- Regional: el cáncer se diseminó a los tejidos que rodean el riñón, a los ganglios linfáticos cercanos y los vasos sanguíneos de la pelvis.
- Metastásico: el cáncer se diseminó a otras partes del cuerpo.
- Recidivante: el cáncer recidivó (volvió) después del tratamiento. Es posible que el cáncer reaparezca en la pelvis renal, la uretra u otras partes del cuerpo, como los pulmones, el hígado o los huesos.
Tratamiento
Las opciones de tratamiento dependen de los siguientes aspectos:
- El estadio y el grado del tumor.
- El lugar donde está el tumor.
- Si el otro riñón del paciente está sano.
- Si el cáncer recidivó.
Cada vez se están llevando a cabo protocolos de tratamiento menos invasivos, con el objetivo de preservar la unidad renal y ofrecer una mejor calidad de vida a los pacientes. Esto gracias al advenimiento de importantes avances tecnológicos en endourología y al entrenamiento exhaustivo de nuestros especialistas.
Tratamiento estándar
Procedimientos endourológicos conservadores del órgano (Tratamiento endoscópico con láser del tumor de vía urinaria superior)
Fulguración láser: es un procedimiento quirúrgico que destruye el tejido mediante un haz láser. La cirugía se lleva a cabo mediante ureterorrenoscopia o acceso percutáneo, es decir, utilizando instrumentos delgados que se introducen a través de los orificios naturales o a través de una pequeña incisión en un costado. No todos los estadios y grados tumorales pueden tratarse de esta manera; está reservado para tumores de bajo grado, únicos, menores de 2cm y que no producen obstrucción de la vía urinaria. La fulguración láser puede considerarse un tratamiento curativo sólo en situaciones concretas, pues se registran entre 50-70% de recurrencias tras el procedimiento, lo que obligaría a un seguimiento muy estrecho y a repetir cada poco tiempo la exploración de la vía urinaria. La gran ventaja de este procedimiento es que permite la preservación del riñón, evitando su extirpación. Está indicado en pacientes con tumores uroteliales poco agresivos en pacientes con un solo riñón o pacientes con insuficiencia renal para evitar la diálisis.
Cirugía
Para el tratamiento de cáncer de células de transición de pelvis renal y de uréter se utiliza uno de los siguientes procedimientos quirúrgicos:
- Nefroureterectomía: cirugía para extirpar todo el riñón, el uréter y el manguito de la vejiga (tejido que conecta el uréter con la vejiga). Es indicado en los tumores localizados que no son susceptibles de manejo endoscópico con fulguración láser. También se realiza en la enfermedad localmente avanzada o metastásica, representando una opción paliativa. La cirugía se completa con una linfadenectomía regional (extirpación de los ganglios linfáticos de la pelvis).
- Resección segmentaria del uréter: procedimiento quirúrgico para extirpar la parte del uréter que contiene el cáncer y parte del tejido sano que lo rodea. Luego, se vuelven a unir los extremos del uréter. Este tratamiento se utiliza cuando el cáncer es superficial y se localiza sólo en el tercio inferior del uréter, cerca de la vejiga. La realización de este procedimiento en otras localizaciones ureterales se asocia a una tasa alta de recidiva. La cirugía se completa con una linfadenectomía regional (extirpación de los ganglios linfáticos de la pelvis).
En cualquiera de estas técnicas, se puede utilizar la cirugía mínimamente invasiva, ya sea la cirugía laparoscópica o la cirugía robótica. La nefroureterectomía radical laparoscópica y robótica han demostrado buenos resultados oncológicos, así como una menor tasa de sangrado intraoperatorio y un mejor postoperatorio
Quimioterapia y tratamientos inhibidores de “check-point” celular
La quimioterapia adyuvante (tras la cirugía) logra una tasa sin recidivas de hasta el 50%, y tiene un efecto sobre la supervivencia. No todos los pacientes reciben este tratamiento debido a enfermedades concomitantes y a la alteración de la función renal tras la cirugía radical. El esquema de tratamiento que se utiliza está basado en el uso del cisplatino, en combinación con otros quimioterápicos. En los casos en que la enfermedad progrese a pesar del uso de quimioterapia, o en el caso de que la función renal no sea buena y, por tanto, no se pueda administrar quimioterapia, se podrán utilizar tratamientos basados en tratamientos inhibidores de “check-point” celular como son el Pembrolizumab, Atezolizumab y el Nivolumab.
Radioterapia
El uso de radioterapia postoperatoria para neoplasias malignas de la pelvis renal sigue siendo aún motivo de controversia, pues se asume que éstas son radiorresistentes. Existe poca evidencia sobre su uso en tumores de vía superior.
Pronóstico
El pronóstico depende del estadio y el grado del tumor. La supervivencia a 5 años para el carcinoma de células transicionales es de 50%, pero si el tumor es indiferenciado solamente el 25% de los pacientes sobreviven después de 5 años. El carcinoma epidermoide tiene una capacidad inusualmente agresiva para extenderse a los ganglios linfáticos regionales, y por ello cualquier tipo de tratamiento no modifica su sobrevida, siendo casi siempre mortal en el plazo de un año y con una sobrevida quinquenal inferior al 10%.
A causa del carácter multicéntrico de estos tumores y de la propensión a la recidiva, los pacientes deben vigilarse cuidadosamente aún después de una cirugía radical.
El diagnóstico precoz y el tratamiento oportuno de estas neoplasias son factores fundamentales en el pronóstico de estos pacientes.
Seguimiento
Se efectúan cistoscopia, citologías urinarias y tomografías del tórax, abdomen y pelvis, cada 3 meses durante 2 años, cada seis meses en los 2 años siguientes y después anualmente. El motivo de realizar la cistoscopia con tanta asiduidad es porque el 30 a 50% de pacientes con carcinoma de células transicionales de pelvis renal, pueden desarrollar sincrónicamente esta neoplasia en la vejiga.
Para los tumores tratados mediante fulguración láser se llevan a cabo ureterorrenoscopias cada 3 meses durante 2 años, y luego cada 6 meses, si bien es cierto que los protocolos pueden variar dependiendo de los hallazgos operatorios y del estado de salud del paciente.
Tumores benignos de la glándula suprarrenal
Las glándulas suprarrenales son unos pequeños órganos que se localizan, tal como su nombre lo indica, por encima y adyacente a ambos riñones. Tienen forma de Y, V o T invertidas y pesan aproximadamente 5 gramos cada una. La corteza suprarrenal secreta cortisol, aldosterona y andrógenos; la médula secreta epinefrina y norepinefrina.
Los tumores benignos de la glándula suprarrenal son frecuentes, afectando al 9% de la población; sin embargo, los cánceres son muy infrecuentes. La detección de los tumores ha aumentado significativamente con el uso cada vez más frecuente de la tomografía computada (TC) y resonancia magnética (RM), en las que muchas de estas lesiones son detectadas en forma incidental.
Las lesiones más comunes son el adenoma y las metástasis, siendo el adenoma la patología más prevalente en los pacientes sin antecedente neoplásico. Además de éstos, a nivel suprarrenal se pueden encontrar feocromocitomas, carcinomas, linfomas, mielolipomas, quistes y pseudoquistes, hemangiomas y hematomas, entre otros.
Adenomas
Constituyen un hallazgo común en TC y RM. Son pequeños, no funcionantes, se encuentran en pacientes asintomáticos y corresponden a un hallazgo incidental. Una minoría de adenomas son hiperfuncionantes, responsables de trastornos endocrinos como los síndromes de Cushing (exceso de glucocorticoides) o de Conn (hiperaldosteronismo), en que los adenomas suprarrenales representan un 20% y un 80% de éstos, respectivamente. Esta lesión se caracteriza histológicamente por la presencia de células claras con abundante lípido intracitoplasmático (grasa microscópica) separado por tejido fibrovascular.
Metástasis
Es la lesión maligna más común de las glándulas suprarrenales, siendo éste el cuarto sitio más frecuente de metástasis en el cuerpo, a pesar del tamaño de estas glándulas. Neoplasias primarias que metastatizan frecuentemente a las glándulas suprarrenales provienen de pulmón, mama, riñón, intestino y páncreas. El melanoma es un tumor poco frecuente, que también metastatiza a estos órganos. Las metástasis son frecuentemente bilaterales, de mayor tamaño que los adenomas, heterogéneas y de contornos irregulares en las pruebas de imagen.
Feocromocitoma
Es un tumor raro, secretor de catecolaminas, originado del tejido neuroectodérmico de la médula suprarrenal. Los síntomas derivados de este tumor son secundarios al exceso de epinefrina y norepinefrina; entre éstos se incluyen la hipertensión arterial episódica, cefalea, ansiedad y palpitaciones.
Ha sido llamado el tumor de los 10%s: 10% bilaterales, 10% extraadrenales, 10% malignos, 10% en niños, 10% asociado a síndromes, como neoplasias endocrinas múltiples NA y III, síndrome de Von Hippel Lindau y neurofibromatosis. El diagnóstico es clínico y de laboratorio (elevación de catecolaminas plasmáticas y urinarias) y por otro lado a través de pruebas complementarias, ya sea por TC o RM, que presentan un rendimiento similar en la detección de estos tumores en las glándulas suprarrenales.
Los feocromocitomas por lo general miden entre 2 y 5 cm, son hipervasculares y presentan abundante líquido, muchos de ellos con áreas quísticas en su interior. Cuando se localizan en situación extraadrenal se denominan paragangliomas y deben buscarse caudal al origen de la arteria mesentérica inferior o adyacente a la bifurcación aórtica.
La cirugía radical es el único tratamiento que puede llevar a la remisión completa.
Mielolipoma
Tumor benigno poco frecuente, compuesto por tejido adiposo maduro y hematopoyético. La mayoría son descubiertos en forma incidental; en ocasiones pueden sangrar.
Linfoma
El compromiso por esta enfermedad es poco frecuente, siendo en la mayoría de los casos del tipo no-Hodgkin. De los pacientes con linfoma no-Hodgkin, el 4% presentan compromiso suprarrenal.
Lesiones quísticas
Son poco comunes, demostrándose en el 0,1% de las autopsias. Usualmente son asintomáticas, y ocurren preferentemente entre la tercera y quinta década de la vida. Pueden asociarse a dolor o masa palpable cuando son muy grandes. Se dividen en cuatro subtipos: quistes revestidos de endotelio (40%), pseudoquistes posthemorragia (39%), quistes parasitarios, quistes revestidos de epitelio.
Hematomas
Ocurren en relación a trauma, en especial cuando hay compromiso del lóbulo hepático derecho y compresión directa de la glándula suprarrenal ipsilateral contra la columna. También pueden ser visualizados en el contexto de trombosis de vena suprarrenal, hipotensión y shock.
Tratamiento quirúrgico de los tumores benignos de la glándula suprarrenal
La cirugía laparoscopia en los adenomas suprarrenales, fue la primera cirugía laparoscópica que demostró las ventajas actuales de la cirugía mínimamente invasiva. La cirugía laparoscópica, la cirugía por retroperitoneoscopia y la cirugía robótica de la glándula suprarrenal ha demostrado un menor sangrado operatorio, menor tiempo operatoria, mejor recuperación postoperatoria, menor estancia hospitalaria y menor tiempo hasta la recuperación de la actividad laboral, por lo que actualmente se consideran las técnicas de elección para la realización de cirugía suprarrenal.
Tumor maligno de la glándula suprarrenal (carcinoma suprarrenal)
Tumor raro (0,02% de todos los cánceres, con incidencia global entre el 0,5-2/1.000.000 habitantes), originado de la corteza suprarrenal, en general entre la cuarta y séptima décadas de la vida. Afecta a ambos sexos, con una discreta preponderancia femenina, especialmente hacia el final de la tercera y cuarta décadas, aunque puede presentarse en edades extremas. Es hiperfuncionante en un 20-40% de los casos, manifestándose más comúnmente como síndrome de Cushing. Puede presentarse con dolor abdominal y masa palpable.
Al diagnóstico, el tumor es grande, en general mayor a 6 cm, alcanzando en algunos casos hasta 20 cm. Puede observarse invasión directa de órganos vecinos, de la vena renal y vena cava inferior. Aproximadamente el 50-60% de los casos presentan clara evidencia de diseminación locorregional o a distancia en el momento del diagnóstico.
La etiología es desconocida, no habiéndose identificado factores predisponentes; sin embargo, se sabe que las células tumorales despliegan diversos fallos enzimáticos en los sistemas de la génesis de esteroides (11-beta-hidroxilasa, 17-alfa-hidroxilasa, 21-hidroxilasa, 3-beta-hidroxiesteroide-deshidrogenasa y delta5-delta4-isomerasa). Por tanto, se supone que el origen tumoral toma lugar en algún punto de este fallo enzimático. Además, se ha demostrado una pérdida de alelos en los cromosomas 11p, 13q y 17p de carcinomas no presentes en casos de adenomas o hiperplasias.
Los tumores adrenales son más frecuentes dentro del espectro de varios síndromes genéticos, como el síndrome de Gardner, el de Li-Fraumeni y el de Beckwith-Wiedemann. Asimismo, el 52% de los tumores muestran positividad inmunohistoquímica para el gen p53, 80% para el gen del retinoblastoma (RB), 22% para el gen del neuroblastoma, y 20% para el gen del von Hippel Lindau.
Síntomas
El tumor se palpa como una masa abdominal en el 30-40% de los pacientes a consecuencia de su lento crecimiento. Dependiendo del tamaño y localización puede producir síntomas gastrointestinales como saciedad precoz, sensación de distensión, náuseas y vómitos. Astenia, fatiga, pérdida de peso y febrícula son síntomas frecuentes, al igual que el dolor abdominal. La tendencia a invadir las estructuras vasculares es la causa de que se originen síntomas atípicos secundarios a trombosis de cava inferior (edemas periféricos), vena renal (hematuria y proteinuria) o tronco portal (hipertensión portal con hepatoesplenomegalia).
Los tumores funcionantes pueden producir sustancias que causan síntomas muy diversos. En el hombre, los síntomas se engloban en un síndrome clínico denominado hiperandrogenismo (aumento de grosor del pelo, calvicie temporal, acné). En el caso de la mujer, el 75% de estos tumores se manifiesta en forma de virilización (hirsutismo, amenorrea, hipertrofia del clítoris, aparición de barba, entradas temporales y calvicie). Estos síntomas están mediados por la secreción de la hormona DHEA-S. En ambos sexos puede darse el hipercortisolismo, desarrollándose un síndrome de Cushing (cara de luna llena, morrillo de búfalo, plétora, equimosis, hipertensión e hipopotasemia con igual frecuencia, adelgazamiento cutáneo, estrías e hipertrofia ventricular izquierda). En niños, se manifiesta con pubertad precoz. Menos frecuentemente pueden aparecer síntomas debidos a la hipersecreción de mineralocorticoides, insulina, eritropoyetina, vasopresina, estrógenos y hormona del crecimiento.
Metástasis: en términos de diseminación a distancia, el carcinoma suprarrenal metastatiza en el pulmón (60%), hígado (50%), linfáticos (48%), hueso (24%), pleura y corazón (1%), siendo muy poco frecuente la metastatización a riñón (5%) y cerebro (4%).
Clasificación clínico-histológica
Puede ser dividido en:
- Variante diferenciada, compuesta por células que se asemejan a las normales, dispuestas de forma organizada.
- Variante indiferenciada o pleomórfica, compuesta por células con núcleos bizarros, desordenadas, con falta de cohesión entre sí.
Diagnóstico
Ante la sospecha de un carcinoma adrenal, la secuencia diagnóstica se encamina a demostrar el grado de función, a identificar el grado de invasión local y a descartar la presencia de metástasis.
Estudio radiológico
La primera técnica de imagen a utilizar en el paciente en quien se sospecha un carcinoma adrenal es el TAC o RM, seguida de la gammagrafía con I-colesterol que aporta una información adicional sobre la naturaleza funcional. La tomografía de emisión de positrones (PET) con desoxiglucosa o fludesoxiglucosa-F-18 ha demostrado ser un magnífico método para diagnosticar las masas adrenales en pacientes con carcinomas conocidos.
Estudio hormonal
Además de las pruebas radiológicas se utilizan estudios funcionales, en los que se intenta detectar residuos metabólicos de las sustancias que produce el propio tumor, debido a sus propios fallos enzimáticos (los más frecuentes son el de la 11-beta-hidroxilasa y el de la 3-beta-hidroxiesteroide-deshidrogenasa). Este estudio se llama análisis cromatográfico de los distintos esteroides. Las alteraciones encontradas son:
- Los producidos por el síndrome de Cushing: marcada eliminación de cortisol en sangre y orina
- Los producidos por el hiperandrogenismo: marcada eliminación de 17-cetos y de 11-desoxicortisol en orina. Aumento de DHEA-S plasmática. La DHEA-S es el mejor marcador del carcinoma y sus concentraciones plasmáticas permanecen elevadas y no suprimidas a valores normales tras la supresión con 2 mg de dexametasona/día durante 5 días.
- Los producidos por la feminización / pubertad precoz: elevación de estradiol, estrona y/o estriol; eliminación urinaria aumentada de 17-cetos en orina.
- Los producidos por el aldosteronismo: elevación de precursores como la DOCA y la 18-hidroxicorticosterona. Además, aparece hipopotasemia. Es típica la falta de respuesta a la infusión de ACTH. Asimismo, los carcinomas no muestran el clásico descenso de aldosterona por los cambios posturales.
Estadificación
La enfermedad puede clasificarse, dependiendo de su extensión, en:
- Enfermedad localizada: tumor que tras su extirpación está confinado a la adrenal no pudiéndose poner de manifiesto la existencia de metástasis. Menos del 5% de los carcinomas adrenales se encuentran en esta categoría.
- Enfermedad regional: tumor con afectación del/los tejidos contiguos y de los órganos de vecindad, incluyendo los ganglios linfáticos, pero sin evidencia de metástasis a distancia. Entre el 20-30% de los tumores se incluyen en este grupo.
- Enfermedad a distancia: tumores metastatizados en el momento del diagnóstico. En este grupo se incluyen el 40-60% de los tumores.
- Enfermedad recurrente: aparición de recidiva local o diseminación a distancia tras la resección teóricamente curativa del tumor primario.
Según el estadio, puede clasificarse en:
- Estadio I: (T1N0M0). Tumor menor de 5 cm sin ganglios, sin invasión local y sin metástasis.
- Estadio II: (T2N0M0). Tumor mayor de 5 cm sin ganglios, sin invasión local y sin metástasis.
- Estadio III: (T1 o T2N1M0 o T3N0M0). Cualquier tamaño, con ganglios o invasión local, sin metástasis.
- Estadio IV: (cualquier T, cualquier NM1 o T3-T4N1). Cualquier tamaño, con ganglios o invasión local, con metástasis.
Pronóstico y evolución
El pronóstico depende de varias características histológicas que despliega el tumor: presencia de zonas extensas de necrosis, bandas de fibrosis, invasión capsular, invasión vascular, arquitectura del tumor (organizado o difuso), proporción de células claras, pleomorfismo nuclear, actividad mitótica y presencia de mitosis atípicas.
En general el pronóstico es muy malo, con una mortalidad entre el 65-94% a los 5 años, una supervivencia media de 29 meses y una supervivencia media actuarial del 35% a 5 años. Por estadios, la supervivencia actuarial a 5 años puede cifrarse en un 54%-46% para los estadios I-II, en un 43-21% para el III y en un 4-6% para el estadio IV.
Tratamiento
Aunque el carcinoma adrenal es un tumor de alto grado de malignidad y una corta expectativa de vida, debe intentarse un tratamiento que al menos permita un tiempo aceptable de remisión, y en los casos de tumor funcionante, un mejor control de los síntomas.
Cirugía
La cirugía, con visos curativos o paliativos, está indicada en los casos de tumores con enfermedad local o regional, mientras que en los pacientes con tumores diseminados puede ser discutible la indicación de cirugía paliativa de citorreducción, pudiendo ser nuevamente electiva en los casos de metástasis únicas aisladas en órganos asequibles y en los casos de algunas recidivas locales. En otras ocasiones, la cirugía de citorreducción está indicada para facilitar la acción de los fármacos adrenolíticos o de quimioterapia.
La vía de abordaje es abierta en casos de afectación o sospecha de afectación de órganos vecinos. La laparoscopia queda, en este caso, reservada para lesiones localizadas dentro de la glándula. En un alto porcentaje de los casos es necesario realizar una nefrectomía en bloque. Además, se realiza una linfadenectomía regional, que cumple con un propósito doble: oncológico y de estadificación.
En casos seleccionados con invasión de la vena cava puede estar indicada la trombectomía o la resección de la cava infrarrenal, si bien los resultados son tan desesperanzadores que no parece ser una maniobra rutinariamente aconsejable.
Tratamiento adrenolítico
El tratamiento postoperatorio con algunos fármacos de acción adrenolítica puede mejorar y prolongar la supervivencia cuando se instaura inmediatamente después de la cirugía, aunque no se sabe si este tratamiento puede prevenir la aparición de las recidivas locales.
El fármaco de elección es el mitotane o Lysodren (a dosis de 1-2 g/día hasta llegar a 5-6 g/día), utilizado para el tratamiento de la enfermedad metastásica. Este medicamento mejora los síntomas debidos al hipercortisolismo pues, al bloquear la 11-beta-hidroxilasa, reduce drásticamente la síntesis de cortisol. Además, ayuda a reducir la posible aparición de recidivas locales y es hoy por hoy la única alternativa posible en la enfermedad con extensa diseminación a distancia. Los estudios realizados con este fármaco han confirmado remisiones mensurables del tumor de 34-60% y aumento de supervivencia global de un 20-25%. De todos modos, el grado de respuesta clínica no supera el 25%. Los efectos secundarios del mitotane son: náuseas (88%), vómitos (23%), diarrea (38%), debilidad, dermatitis (23%), ginecomastia (50%), artralgias (19%), leucopenia (7%), hipercolesterolemia, hepatotoxicidad, síntomas neurotóxicos (pérdida de memoria y capacidad de concentración en un 50%, somnolencia y vértigos) y prolongación del tiempo de hemorragia por un efecto semejante al de la aspirina. La respuesta, en caso de producirse, tiene una duración media de 6-10 meses.
Quimioterapia
El carcinoma cortical es muy poco sensible a los fármacos de quimioterapia y se ha afirmado que es un tumor intrínsecamente resistente a la quimioterapia.
Radioterapia
La radioterapia tiene sólo un papel paliativo, especialmente en las metástasis óseas dolorosas.
Carcinomas adrenales en niños
En niños, igual que en el adulto, los cánceres adrenales suelen ser tumores mayores de 4 cm, con una preponderancia masculina de 2/1 y una edad media de presentación de unos 5 años. La forma más frecuente de presentación es el hirsutismo (50%) y la virilización (76%), síndrome de Cushing (30%) y feminización (10%), tumoración adrenal no funcionante (8%) o muy raramente asociado con un síndrome de pérdida salina por hiperplasia adrenal congénita. No son infrecuentes las asociaciones con malformaciones de otros órganos, como la hemihipertrofia, síndrome de Beckwith-Wiedemann, malformaciones vasculares, urológicas o tumores cerebrales. El 57% tienen tumor palpable, el 80% enfermedad local, el 7% enfermedad locorregional y el 13% metástasis a distancia en el momento del diagnóstico. Como en el adulto, la supervivencia media es del 50% aproximadamente a los 5 años.
Patología del uraco
El uraco o ligamento umbilical medio es una estructura de la línea media que se extiende desde la cara anterior de la vejiga hacia el ombligo. Es un remanente del desarrollo embrionario que proviene del alantoides (saco vitelino). Lo normal es que se oblitere para las 15 semanas de gestación, y sea ya un cordón fibroso para las 20 semanas.
La persistencia del uraco puede originar varios problemas clínicos, no sólo en niños, también en adultos. Las enfermedades que lo afectan son poco comunes (1 de cada 5.000 personas) y su manifestación abdominal, síntomas o signos urinarios son inespecíficos, por lo cual su diagnóstico no siempre resulta fácil.
La tríada clásica de presentación de la patología del uraco es:
- Secreción a través del ombligo.
- Dolor abdominal.
- Síntomas urinarios.
Dependiendo del modo de presentación, la patología del uraco puede ser:
- Uraco persistente. Cuando el cordón fibroso que se extiende desde el ombligo hasta la cúpula vesical sigue permeable (abierto). Puede contener áreas estrechas, anfractuosas o dilatadas. Es más común en hombres que en mujeres, con una relación 2:1. El uraco persistente puede estar asociado a anomalías congénitas del tracto urinario inferior, como valvas uretrales posteriores o atresia ureteral completa. Pueden complicarse con infecciones y, en casos muy raros, con cáncer. Lamentablemente el cáncer uracal es de pronóstico malo, ya que al momento del diagnóstico generalmente presentan invasión local.
- Divertículo uracal. Se desarrolla cuando la porción supra-vesical del uraco no se cierra y es generalmente asintomática. En las pruebas de imagen aparece como una saliente de perfil de aspecto quístico, en la línea media. Se complica con infecciones del tracto urinario, formación de cálculos intrauracales y tiene relación con un aumento de la prevalencia de carcinoma.
- Seno uracal. Se produce cuando la porción más dilatada del uraco persistente es la que está más cerca del ombligo, continuando con tractos anfractuosos cuando se va acercando a la vejiga. Puede manifestarse con secreciones fétidas a través del ombligo, celulitis, escozor o dolor en la pared del abdomen y formación de calificaciones dentro del seno.
- El quiste uracal. Se desarrolla cuando el uraco se oblitera en los extremos vesical y umbilical, permaneciendo entre estos puntos una porción permeable que acumula secreciones, tomando un aspecto quístico. Generalmente esto ocurre en el tercio inferior. Su tamaño es variable, pero generalmente son pequeños. Cuando se hacen sintomáticos aumenta su tamaño con refuerzo de su pared. Su diagnóstico puede ser mediante ultrasonido o tomografía computada, en la cual se manifiesta como una cavidad llena de líquido en la línea media de la pared abdominal baja. Así como en otras anomalías uracales, la infección es la complicación más común.
Diagnóstico
El diagnóstico se realiza mediante examen físico, palpando el abdomen y detectando la presencia del tracto dilatado debajo de la piel o de calcificaciones en el trayecto uracal. A veces, esto no resulta sencillo, y menos en pacientes obesos.
Las pruebas de imagen que comúnmente se realizan incluyen la ecografía, la tomografía y la resonancia magnética. Son herramientas muy útiles, porque permiten diagnosticar el tipo de patología uracal y la posibilidad de que haya malignidad asociada.
La cistoscopia también asiste en el diagnóstico, pues permite al explorador observar directamente la comunicación del uraco persistente con la cúpula de la vejiga.
Tratamiento
A los pacientes que se les diagnostica una infección de un seno, divertículo o quiste de uraco, se les indica antibióticos con pautas prolongadas y aseo local.
La gran mayoría de las veces el tratamiento definitivo es quirúrgico. La cirugía puede ser laparoscópica o abierta, e incluye la exéresis de todo el cordón uracal, de la cúpula vesical y, a veces, el ombligo.
- SUPRARRENALECTOMÍA
- NEFRECTOMÍA RADICAL LAPAROSCÓPICA
- NEFRECTOMÍA PARCIAL LAPAROSCÓPICA
- NEFRECTOMÍA PARCIAL ROBÓTICA
- NEFROURETERECTOMÍA LAPAROSCÓPICA
- NEFROURETERECTOMÍA ROBÓTICA
- RESECCIÓN TRANSURETRAL DE VEJIGA
- CISTECTOMÍA RADICAL LAPAROSCÓPICA
- CISTECTOMÍA RADICAL ABIERTA
- CISISTECTOMIA RADICAL ROBÓTICA
- RECONSTRUCCIÓN DE LA VÍA URINARIA (DERIVACIÓN O NEOVEJIGA).
- URETEROILEOSTOMÍA TIPO BRICKER.
- NEOVEJIGA ILEAL
- PROSTATECTOMÍA RADICAL LAPAROSCÓPICA
- PROSTATECTOMÍA RADICAL ROBÓTICA
- PRESERVACIÓN DE BANDELETAS NEUROVASCULATRES
- LINFADENECTOMÍA INGUINAL / PÉLVICA / RETROPERITONEAL LAPAROSCÓPICA/ROBÓTICA
- URETRECTOMÍA
- PENECTOMÍA PARCIAL
- PENECTOMÍA TOTAL
- PENECTOMÍA RADICAL
- ORQUIECTOMÍA INGUINAL