- PATOLOGIA / SÍMPTOMES:
- Càncer d′uretra
- Càncer de penis
- Càncer de testicle
- Càncer de bufeta
- Càncer de pròstata
- Càncer de ronyó
- Càncer de via urinària superior
- Tumors benignes de la glàndula suprarenal
- Tumor maligne de la glàndula suprarenal
- Patologia de l′uraco
- TRACTAMENTS
- CÀNCER D’ URETRA.
- CÀNCER DE PENIS.
- CÀNCER DE TESTICLE.
- CÀNCER DE BUFETA.
- CÀNCER DE PRÒSTATA.
- CÀNCER DE ROÑON.
- CÀNCER DE VIA URINÀRIA SUPERIOR.
- TUMORS BENIGNES DE LES GLÀNDULES SUPRARENALS.
- TUMOR MALIGNE DE LES GLÀNDULES SUPRARENALS (CARCINOMA ADRENAL).
- PATOLOGIA DE L’ URACO.
Càncer d’ uretra
El càncer d’uretra és una malaltia que consisteix en la formació de cèl·lules cancerígenes o malignes en els teixits que comprenen la uretra, el tub que transporta l’orina des de la bufeta fins a l’exterior de l’organisme. La mida d’aquesta varia segons el sexe, en els homes té una mida més gran que en les dones.
Aquest tipus de càncer, és poc freqüent en la població i es donen més casos en homes.
Etiologia
Les causes per patir càncer d’uretra no estan clares. Hi ha persones que tenen més factors de risc per patir aquesta malaltia, tot i que això no significa que la vagi a contreure. Els factors que poden incrementar les possibilitats són:
- Tenir antecedents familiars amb aquesta patologia.
- Tenir alguna afecció que afecti la uretra, ocasionant inflamació crònica. Les més importants són: infeccions de transmissió sexual, com el virus del papil·loma humà (VPH) i les infeccions d’orina recurrents.
- Tenir antecedents de càncer vesical, ja que poden aparèixer implants en la uretra durant l’evolució d’aquesta malaltia.
Símptomes
Els signes d’aquesta malaltia no se solen mostrar en els primers estadis. Entre els més freqüents trobem:
- Dificultat per orinar.
- Ganes freqüents d’orinar, especialment a la nit.
- Flux en orinar feble o interromput, unit moltes vegades a la dificultat de buidar per complet la bufeta.
- Incontinència o incapacitat de controlar l’ orina a la bufeta.
- Secreció provinent de la uretra.
- Presència de sang a l’ orina.
- Engrosseixament del penis en els homes o la presència d’ un embalum en les dones.
Subtipus
Les variants de càncer d’uretra depenen dels teixits que revesteixen aquest conducte i dels tipus de cèl·lules que el componen. La patologia es pot disseminar i metastatitzar cap a teixits pròxims o als ganglis limfàtics. Els subtipus coneguts del càncer uretral són:
- El carcinoma de cèl·lules escamoses és el tipus més comú de càncer d’uretra.
- El carcinoma de cèl·lules de transició es forma en l’àrea propera a l’obertura uretral en les dones i en la part de la uretra que passa a través de la pròstata en els homes.
- L’adenocarcinoma es forma en les glàndules que envolten la uretra en els homes i en les dones.
Segons la localització del tumor, podem diferenciar entre:
- Càncer d’ uretra distal: a la zona més propera a l’ exterior de l’ organisme.
- Càncer d’ uretra proximal: localitzat en la part més propera a la bufeta.
Diagnòstic
En el diagnòstic del càncer d’ uretra s’ empren múltiples eines, ja que s’ ha de determinar no només la presència d’ implants tumorals en l’ òrgan, sinó també la possibilitat que s’ hagi estès a altres parts del cos. En el diagnòstic es recapta informació per mitjà de:
- Examen físic i antecedents de salut: examen del cos per revisar l’ estat general de salut i identificar qualsevol signe de malaltia, com masses o qualsevol altra cosa que sembli anormal. També es prenen dades sobre els hàbits de salut, els antecedents de malalties i els tractaments anteriors.
- Examen pelvià: examen de la vagina, el coll uterí, l‘úter, les trompes de Falopio, els ovaris i el recte.
- Examen digital del recte: examen del recte
- Estudi citològic de l’ orina: prova de laboratori mitjançant la qual s’ observa l’ orina al microscopi per detectar cèl·lules anormals.
- Anàlisi d’ orina: prova per analitzar el color de l’ orina i el seu contingut.
- Analítica de sang: proves per les quals s’ examina una mostra de sang per mesurar la quantitat de certes substàncies que els òrgans i teixits del cos alliberen a la sang.
- Uretroscòpia: procediment per observar l’ interior de la uretra i verificar la presència d’ àrees anormals.
- Biòpsia: extracció de cèl·lules o mostres de teixits de la uretra.
El procés que s’utilitza per determinar si el càncer es va dissecundar dins de la uretra o a altres parts del cos s’anomena estadificació. La informació que s’ obté en el procés d’ estadificació determina l‘estadi de la malaltia. És important saber en quin estadi es troba la malaltia per planificar el seu tractament.
Durant el procés d’ estadificació s’ utilitzen els procediments següents:
- Radiografia del tòrax: radiografia dels òrgans i els ossos dins del tòrax.
- Tomografia computada (TC) de la pelvis i l’abdomen: procediment per al qual es pren una sèrie d’imatges detallades de l’interior del cos des d’angles diferents.
- Imatges per ressonància magnètica (RM)
- Uretografia: sèrie de radiografies de la uretra. S’injecta contrast a través de la uretra cap a la bufeta.
Tractaments
Hi ha diferents tipus de tractament disponibles per als pacients de càncer d’uretra.
Tractaments:
Cirurgia
La cirurgia per extirpar el càncer és el tractament més comú del càncer d’uretra. De vegades es realitzen un dels següents tipus de cirurgia.
- Resecció oberta: extracció del càncer per mitjà de cirurgia.
- Resecció transuretral (RTU): cirurgia per extirpar el càncer mitjançant una eina especial introduïda a la uretra.
- Electroresecció amb fulguració: cirurgia per extirpar càncer mitjançant un corrent elèctric.
- Cirurgia làser: procediment quirúrgic per al qual es fa servir un feix de raig làser com si fos un bisturí per fer talls sense sagnat en el teixit o per extirpar o destruir el teixit.
- Dissecció de ganglis limfàtics: de vegades s’ extreuen els ganglis limfàtics de la pelvis i l‘angle.
- Cistouretrectomia: cirurgia per extreure la bufeta i la uretra.
- Cistoprostatectomia: cirurgia per extreure la bufeta i la pròstata.
- Exenteració pèlvica anterior: cirurgia per extreure la uretra, la bufeta i la vagina.
- Penectomia parcial: cirurgia per extreure la part del penis que envolta la uretra fins on es va dissemiar el càncer.
- Penectomia radical: cirurgia per extreure tot el penis.
Si s’extreu la uretra, el cirurgià obrirà una nova via perquè l’orina surti del cos. Aquest procediment s’ anomena derivació de l’ orina . El cirurgià de vegades fa servir una part de l’intestí prim per fer un tub per tal que l’orina passi a través d’una obertura (estoma). Això s’anomena ostomia o urostomia.
Un cop el metge extirpa tot el càncer visible en el moment de la cirurgia, és possible que alguns pacients rebin quimioteràpia o radioteràpia després de la cirurgia per eliminar qualsevol cèl·lula cancerosa que quedi. El tractament administrat després de la cirurgia per disminuir el risc que el càncer torni s’anomena teràpia adjuvant.
Radioteràpia
La radioteràpia és un tractament del càncer per al qual es fan servir raigs X d’alta energia o altres tipus de radiació per destruir les cèl·lules canceroses o impedir que creixin.
Hi ha dos tipus de radioteràpia:
- Radioteràpia externa: tipus de radioteràpia per a la qual es fa servir una màquina que envia la radiació cap a l’ àrea amb càncer des de l’ exterior del cos.
- Radioteràpia interna: tipus de radioteràpia per a la qual es fa servir una substància radioactiva segellada en agulles, llavors, filferros o catèters que es col·loquen directament dins del càncer o a prop d’aquest. La radioteràpia interna també s’anomena braquiteràpia.
La forma en què s’administra la radioteràpia depèn del tipus de càncer i el lloc de la uretra on es va formar el càncer. La radioteràpia externa i interna es fan servir per tractar el càncer d’uretra.
Quimioteràpia
La quimioteràpia és un tractament del càncer en el qual es fan servir medicaments per interrompre la formació de les cèl·lules canceroses, ja sigui mitjançant la seva destrucció o en impedir la seva multiplicació.
Segons la localització del càncer, es poden utilitzar determinats tractaments i d’altres no.
Per al càncer d’uretra distal…
El tractament del càncer d’uretra distal és diferent per a homes i dones.
Per a les dones, el tractament inclou els procediments següents:
- Cirurgia per extirpar el tumor (resecció transuretral), electroresecció i fulguració o cirurgia làser per a tumors que no es van disseminar profundament dins del teixit.
- Braquiteràpia (radioteràpia interna) o radioteràpia externa per a tumors que no es van disseminar profundament dins del teixit.
- Cirurgia per extirpar el tumor (exenteració pèlvica anterior) per a tumors que es van disseminar profundament cap al teixit. De vegades, també s’extirpen els ganglis limfàtics propers (dissecció de ganglis limfàtics). En ocasions, s’administra radioteràpia abans de la cirurgia.
Per als homes, el tractament inclou els procediments següents:
- Cirurgia per extirpar el tumor (resecció transuretral) electroresecció i fulguració o cirurgia làser per a tumors que no es van disseminar profundament cap al teixit.
- Cirurgia per extirpar la part del penis (penectomia parcial) per a tumors que són a prop de la punta del penis. De vegades, també s’extirpen els ganglis limfàtics propers (dissecció de ganglis limfàtics).
- Cirurgia per extirpar part de la uretra per a tumors que estan a la uretra distal però no són a la punta del penis, ni es van disseminar profundament cap al teixit. De vegades, també s’extirpen els ganglis limfàtics propers (dissecció de ganglis limfàtics).
- Cirurgia per extirpar el penis (penectomia radical) per a tumors que es van disseminar profundament dins del teixit. De vegades, també s’extirpen els ganglis limfàtics propers (dissecció de ganglis limfàtics).
- Radioteràpia, amb quimioteràpia o sense aquesta.
- Quimioteràpia administrada juntament amb radioteràpia.
Per al càncer d’uretra proximal…
El tractament per al càncer d’uretra proximal o el càncer d’uretra que afecta tota la uretra és diferent per a homes i dones.
Per a les dones, el tractament inclou els procediments següents:
- Radioteràpia o cirurgia (resecció oberta, resecció transuretral) per a tumors que mesuren 3/4 de polzada o menys.
- Radioteràpia seguida de cirurgia (exenteració pèlvica anterior amb dissecció de ganglis limfàtics i derivació de l’orina).
Per als homes, el tractament inclou el següent procediment:
- Radioteràpia o radioteràpia i quimioteràpia, seguides de cirurgia (cistoprostatectomia, penectomia, dissecció de ganglis limfàtics i derivació de l’orina).
Per al càncer d’uretra derivat del càncer de bufeta
El tractament del càncer d’ uretra que es forma alhora que el càncer de bufeta invasiu inclou els següents procediments:
- Cirurgia (cistouretrectomia per a dones o uretrectomia i cistoprostatectomia per a homes).
Per al càncer d’uretra metastàsic…
El tractament del càncer d’uretra que va fer metàstasi (es va dissessinar a altres parts del cos), per l’habitual és quimioteràpia.
El tractament del càncer d’ uretra recidivant inclou un o més dels següents procediments:
- Cirurgia per extirpar el tumor. De vegades, també s’extirpen els ganglis limfàtics propers (dissecció de ganglis limfàtics).
- Radioteràpia.
Càncer de penis
Factors de risc
La infecció pel virus del papil·loma humà (VPH) és el factor de risc més associat amb el càncer de penis. Hi ha més de 100 serotipus, però només alguns incrementen la possibilitat d’aparició de càncer en els òrgans genitals.
Altres factors involucrats són:
- Edat major de 60 anys.
- Fimosi (afecció per la qual el prepuci del penis no es pot moure cap enrere sobre el glande).
- Higiene personal inadequada.
- Consum de productes de tabac.
Símptomes
Els signes i símptomes que suggereixen la presència de càncer de penis són:
- Enrogiment, irritació o una llaga al penis.
- Úlceres que no curen.
- Una massa al penis.
Diagnòstic
Es realitza el següent:
- Examen físic i antecedents: examen del cos per revisar l’ estat general de salut i identificar qualsevol signe de malaltia en el penis, com masses o qualsevol altra cosa que sembli anormal. També es prenen dades sobre els hàbits de salut, els antecedents de malalties i els tractaments anteriors.
- Biòpsia: extracció de cèl·lules o teixits perquè un patòleg els observi al microscopi i determini si hi ha signes de càncer. La mostra de teixit s’ extreu mitjançant un dels següents procediments.
- Biòpsia per incisió: extracció d’ una part d’ una massa o d’ una mostra de teixit que no té aspecte normal.
- Biòpsia per escissió: extracció completa d’ una massa o àrea de teixit que no té aspecte normal.
Estadificació
En el diagnòstic és important determinar si el càncer de penis està localitzat o s’ha estès a altres regions del cos. S’utilitzen diverses proves complementàries que ubicaran el cas dins d’ un estadi clínic concret: 0, I, II, III o IV. És important saber l’estadi per planificar el tractament.
Estadis del càncer de penis
Els diferents estadis són:
Estadi 0
L’estadi 0 es divideix en els estadis 0is i 0a.
- A l’estadi 0is, es troben cèl·lules anormals a la superfície de la pell del penis. Aquestes cèl·lules anormals formen embalums que de vegades es tornen
cancerosos i es disseminen al teixit normal proper. L’estadi 0is també s’anomena carcinoma in situ o neoplàsia intraepitelial de penis. - A l’estadi 0a, el càncer de cèl·lules escamoses que no es dissemina es troba a la superfície de la pell del penis o a la superfície interna del prepuci
del penis. L’estadi 0a també s’anomena carcinoma de cèl·lules escamoses localitzat no invasiu.
Estadi I
A l’estadi I, el càncer es va formar i es va dissecundar al teixit que està just sota la pell del penis. El càncer no es va dissecundar als vasos limfàtics, els vasos sanguinis ni els nervis. Les cèl·lules canceroses s’assemblen a les cèl·lules normals quan s’observen al microscopi.
Estadi II
L’estadi II es divideix en els estadis IIA i IIB.
A l’estadi IIA, el càncer es va dissecundar de la següent manera:
- al teixit que està just sota la pell del penis. El càncer es va dissecuinar als vasos limfàtics, els vasos sanguinis o els nervis; o
- al teixit que està just sota la pell del penis. Les cèl·lules canceroses es veuen molt anormals o són sarcomatoides quan s’observen al microscopi; o
- al cos esponjós (teixit esponjós erèctil del cos del penis i el glande que s’omple de sang durant una erecció).
A l’estadi IIB, el càncer es va dissecundar de la següent manera:
- a través de la capa de teixit conjuntiu que envolta el cos cavernós (teixit esponjós erèctil del cos del penis) i dins del cos cavernós.
Estadi III
L‘ estadi III es divideix en els estadis IIIA i IIIB. El càncer es troba al penis.
- A l’estadi IIIA, el càncer es va dissecundar a 1 o 2 ganglis limfàtics d’un costat de l’angle.
- A l’estadi IIIB, el càncer es va dissecundar a 3 o més ganglis limfàtics d’un costat de l’angle, o als ganglis limfàtics d’ambdós costats de l’angle.
Estadi IV
A l’estadi IV, el càncer es va dissecundar de la següent manera:
- als teixits propers al penis, com l’escrot, la pròstata o el pubis, i és possible que s’hagi disseminat als ganglis limfàtics de l’angle o la pelvis; o
- a un o més ganglis limfàtics de la pelvis, o el càncer es va dissecuinar a través de la coberta externa dels ganglis limfàtics al teixit proper; o
- als ganglis limfàtics fora de la pelvis o fins a altres parts del cos, com els pulmons, el fetge o els ossos.
Tractaments
Cirurgia
La cirurgia és el tractament més comú per a tots els estadis del càncer de penis. Un metge pot extirpar el càncer mitjançant una de les següents operacions:
- Cirurgia ecogràfica de Mohs: procediment en el qual es talla el tumor de la pell en capes primes. Durant la cirurgia, s’observen al microscopi les vores del tumor i cadascuna de les capes del tumor que s’extreuen per determinar si hi ha cèl·lules canceroses. S’extirpen capes fins que ja no es veuen cèl·lules canceroses. Amb aquest tipus de cirurgia s’extreu la menor quantitat possible de teixit normal i sovint s’utilitza per extreure el càncer que està a la pell. Aquest procediment també s’anomena cirurgia de Mohs.
- Cirurgia làser: procediment quirúrgic per al qual es fa servir un raig làser com si fos un bisturí per fer talls sense sagnat en el teixit o per extirpar una
lesió superficial, com un tumor. - Criocirurgia: tractament per al qual es fa servir un instrument per congelar i destruir teixit anormal. Aquest tipus de tractament també s’anomena crioteràpia.
- Circumcisió: cirurgia per extreure una part o tot el prepuci del penis.
- Escissió local àmplia: Cirurgia per extirpar el càncer i alguna cosa del teixit sa que l’envolta.
- Amputació del penis: Cirurgia per extirpar una part o tot el penis. Si s’extreu una part del penis, l’amputació és una penectomia parcial. Si s’extreu tot el penis, és una penectomia total.
Durant la cirurgia, de vegades s’extirpen els ganglis limfàtics de l’angle.
Després que el metge extirpa tot el càncer visible en el moment de la cirurgia, és possible que alguns pacients rebin quimioteràpia o radioteràpia per destruir qualsevol cèl·lula cancerosa que quedi. El tractament que s’administra després de la cirurgia per disminuir el risc que el càncer torni s’anomena teràpia adjuvant.
Radioteràpia
La radioteràpia és un tractament del càncer per al qual es fan servir raigs X d’alta energia o altres tipus de radiació per destruir cèl·lules canceroses o impedir que creixin. Hi ha dos tipus de radioteràpia.
- Radioteràpia externa: tipus de radioteràpia per a la qual es fa servir una màquina que envia la radiació cap al càncer des de l’ exterior del cos.
- Radioteràpia interna: tipus de radioteràpia per a la qual es fa servir una substància radioactiva segellada en agulles, llavors, filferros o catèters que es col·loquen directament en el càncer o a prop d’aquest.
Quimioteràpia
La quimioteràpia és un tractament del càncer en el qual es fan servir medicaments per interrompre la formació de cèl·lules canceroses, ja sigui mitjançant la seva destrucció o en impedir la seva multiplicació.
Medicaments biològics
La teràpia biològica és un tractament en el qual es fa servir el sistema immunitari del pacient per combatre el càncer. S’ utilitzen substàncies elaborades pel cos o produïdes en un laboratori per impulsar, dirigir o restaurar les defenses naturals del cos contra el càncer. Aquest tipus de tractament del càncer també s’anomena bioteràpia o immunoteràpia. La teràpia biològica tòpica amb imiquimod de vegades es fa servir per tractar el càncer de penis en estadi 0.
Biòpsia del gangli sentinella
La biòpsia de gangli limfàtic sentinella és l’extracció del gangli limfàtic sentinella durant una cirurgia. El gangli limfàtic sentinella és el primer gangli d’un grup de ganglis limfàtics que rep el drenatge limfàtic del tumor primari. És el primer gangli limfàtic on és probable que el càncer del tumor primari es dissemini. S’injecta una substància radioactiva o un tint blau a prop del tumor. La substància o el tint flueixen a través dels conductes limfàtics fins als ganglis limfàtics. S’extreu el primer gangli que rep la substància o el tint.
Un patòleg observa el teixit al microscopi per detectar cèl·lules canceroses. Si no es detecten cèl·lules canceroses, potser no es necessiti extirpar més ganglis limfàtics. De vegades, es troba un gangli limfàtic sentinella en més d’un grup de ganglis limfàtics. Després de la biòpsia de gangli limfàtic sentinella, el cirurgià extirpa el càncer.
Segons cada estadi, es poden fer servir certs tipus de tractaments i d’altres no.
Estadi 0
El tractament per a l‘estadi 0 inclou un dels procediments següents:
- Microcirurgia de Mohs.
- Quimioteràpia tòpica.
- Teràpia biològica tòpica amb imiquimod.
- Cirurgia làser.
- Criocirurgia.
Estadi I
Si el càncer es troba sol en el prepuci, és possible que només es necessiti un tractament d’escissió local àmplia i circumcisió.
El tractament per al càncer de penis en estadi I inclou els següents procediments:
- Cirurgia (penectomia parcial o total, amb extracció dels ganglis limfàtics de l’angle o sense aquesta).
- Radioteràpia externa o interna.
- Microcirurgia de Mohs.
- Participació en un assaig clínic de teràpia làser.
Estadi II
El tractament per al càncer de penis en estadi II inclou els següents procediments:
- Cirurgia (penectomia parcial o total, amb extracció dels ganglis limfàtics de l’angle o sense aquesta).
- Radioteràpia externa o interna seguida de cirurgia.
- Participació en un assaig clínic de biòpsia de gangli limfàtic sentinella seguida de cirurgia.
- Participació en un assaig clínic de cirurgia làser.
Estadi III
El tractament per al càncer de penis en estadi III inclou els següents procediments:
- Cirurgia (penectomia i extracció de ganglis limfàtics de l’angle, amb radioteràpia o sense aquesta).
- Radioteràpia.
- Participació en un assaig clínic de biòpsia de gangli limfàtic sentinella seguida de cirurgia.
- Participació en un assaig clínic de radiosensibilitzadors.
- Participació en un assaig clínic de quimioteràpia, abans o després de la cirurgia.
- Participació en un assaig clínic amb medicaments nous, teràpia biològica o nous tipus de cirurgia.
Estadi IV
El tractament per al càncer de penis en estadi IV en general és pal·liatiu (per alleujar els símptomes i millorar la qualitat de vida). El tractament inclou els procediments següents:
- Cirurgia (escissió local àmplia i extracció dels ganglis limfàtics de l’angle).
- Radioteràpia.
- Participació en un assaig clínic de quimioteràpia, abans o després de la cirurgia.
- Participació en un assaig clínic amb medicaments nous, teràpia biològica o nous tipus de cirurgia.
Càncer de testicle
El càncer de testicle és el tumor més freqüent en homes entre els 15 i els 35 anys. No obstant això, després d’aquest pic d’incidència es converteix en una raresa i, en general només suposa l’1% del total dels tumors diagnosticats en varons. A Espanya, el passat 2019 es van diagnosticar aproximadament 1.300 casos nous. La seva freqüència varia als diferents països per motius que desconeixem.
Des dels anys 90 el nombre de casos diagnosticats va en augment per causes que es desconeixen, tot i que la mortalitat ha descendit, reflectint les millores en el tractament d’aquests pacients.
Afortunadament, la gran majoria dels pacients es curen, fins i tot en aquells casos en què la malaltia es presenta inicialment ja molt avançada. Això és possible fonamentalment gràcies als esquemes de quimioteràpia.
Etiologia
La causa concreta del càncer de testicle resulta desconeguda, igual que la d’altres molts tumors; però sí que s’han identificat alguns factors de risc amb una clara associació amb els tumors germinals.
El principal factor de risc és la criptorquídia (falta de descens del testicle fins a l’escrot durant els primers anys de vida).
Entre l’1 i el 3% dels pacients amb tumors germinals tenen història familiar de càncer de testicle, la qual cosa suggereix un component hereditari. De la mateixa manera, els germans o els fills d’aquests malalts tenen fins a 10 vegades més risc de desenvolupar la malaltia. Tanmateix, encara no estan ben establerts els factors genètics responsables.
Prevenció
En termes generals no hi ha cap forma de prevenir el càncer de testicle, perquè no es coneix cap factor de risc que es pugui evitar. A més, la freqüència de la malaltia és baixa, fins i tot en les persones que presenten factors de risc. D’altra banda, sí que està demostrat que l’orquidopèxia (intervenció mitjançant la qual es baixa i fixa un testicle no descendit a l’escrot de forma natural) preveu el desenvolupament de càncer de testicle en el subgrup dels nens amb criptorquídia.
No està recomanada la realització d’ exploracions o proves rutinàries per diagnosticar-lo de forma precoç en la població general, atès que és un tumor poc freqüent, de fàcil diagnòstic en estadis inicials i de bon pronòstic. No obstant això, sí que és important que la població diana d’aquesta malaltia (entre 15-35 anys) estigui familiaritzada amb els signes i símptomes d’alarma més comuns.
Simptomatologia
La gran majoria dels tumors germinals del got es diagnostiquen perquè el pacient es palpa un embalum al testicle, que amb freqüència no dubta. En els casos en què hi ha dolor, sol aparèixer progressivament, tot i que pot fer-ho de forma sobtada si el tumor es complica amb una infecció (orquiepididimitis) o si sagna. En general els pacients descriuen més una sensació de pes a l’àrea genital o simplement un augment de mida del testicle.
En casos molt més rars, aquests tumors poden ocasionar un creixement de les mames en varons (ginecomastia) per l’augment de la beta-gonadotropina coriònica (β-HCG). En alguns pacients pot existir dolor d’esquena o d’abdomen, causat perquè els estímuls dolorosos del testicle es dirigeixen cap a aquest lloc, o bé perquè existeixin metàstasi (extensions del tumor de testicle a altres zones) en ganglis limfàtics de la part més posterior de l’abdomen (retroperitoneu).
Finalment, en els casos en què existeixen metàstasi en altres òrgans (per exemple, en el pulmó, cervell, os, etc.), aquestes poden produir símptomes molt variats (falta d’aire, inestabilitat, dolor, etc.), depenent de la seva localització.
Tipus histològics
Els tipus histològics són les diferents classes de tumors que es poden desenvolupar en un òrgan. Aquests tipus venen determinats en funció de les característiques microscòpiques del tumor.
En el cas dels tumors de testicle, quan la cèl·lula germinal creix d’una forma anòmala, pot seguir diferents patrons i donar lloc a dues grans famílies de tumors:
– Seminomes: aquests representen aproximadament el 50% dels tumors germinals i solen aparèixer de mitjana 10 anys més tard (entorn de la quarta dècada de la vida). Perquè un tumor de testicle es consideri seminoma, no ha d’estar barrejat amb altres tipus de tumor. Existeixen dos subtipus:
- Seminoma clàssic
- Seminoma atípic
– No seminomes: els tumors no seminomatosos solen aparèixer durant la tercera dècada de la vida. Quan parlem de “no seminoma” en realitat fem al·lusió a un grup que inclou diversos possibles subtipus:
- Carcinoma embrionari
- Coriocarcinoma
- Tumor del si endodèrmic
- Teratoma
El subtipus més freqüent és el carcinoma embrionari, si bé els pacients solen tenir tumors mixtos que barregen en diferent proporció qualsevol d’aquests subtipus i fins i tot parts de seminoma (en aquest cas particular, es continuen considerant no seminomes).
Diagnòstic
Quan s’aborda un probable cas de càncer de testicle, a més de preguntar pels símptomes i explorar el pacient, es completa l’estudi amb les següents proves complementàries:
- Analítica general, incloent-hi LDH, alfa-fetoproteïna i β-hCG. Aquestes substàncies es denominen marcadors tumorals. Són proteïnes produïdes per les cèl·lules del tumor i resultaran molt útils per al diagnòstic i/o el seguiment de la malaltia. La β-HCG pot estar elevada en qualsevol tipus de tumor de testicle, mentre que l’alfa-fetoproteïna només augmenta en els tumors no seminomatosos. La LDH (lactat deshidrogenasa) és una altra proteïna present a la sang que també s’eleva en alguns pacients amb tumors de testicle, i s’haurà de vigilar la seva evolució durant el tractament. No obstant això, com passa en altres tipus de càncer, els marcadors tumorals no augmenten en tots els pacients amb càncer de testicle; ni tampoc qualsevol elevació d’aquestes proteïnes es correspon inequívocament amb el fet de tenir un tumor germinal.
- Ecografia del testicle: és una prova crucial, ja que ens permet distingir un tumor d’ altres entitats benignes que també podrien ocasionar un nòdul palpable en el testicle. Si definitivament es confirma l’existència d’una tumoració, mitjançant ecografia se’n poden observar les característiques (localització, mida, vascularització, etc.), explorar el testicle contralateral, etc.
- Tomografia axial computada (TAC) del tòrax, abdomen i pelvis: permet estudiar la resta d’òrgans del cos i les principals vies de drenatge limfàtic testicular, de manera que és imprescindible per a una correcta estadificació del cas.
A més, es poden realitzar en alguns casos:
- TAC o ressonància nuclear magnètica (RNM) cerebral: si se sospita l’existència de metàstasis cerebrals.
- Gammagrafia òssia: si se sospita l’ existència de metàstasis òssies.
- Tomografia per emissió de positrons (PET): s’utilitza en ocasions per valorar les restes de tumor que poden persistir després del tractament quimioteràpic inicial en casos de malaltia avançada. El PET no està indicat com a procediment de rutina en el diagnòstic inicial de tots els casos.
Estadificació
- Estadi I: el tumor només afecta el testicle.
- Estadi II: el tumor s’estén a ganglis limfàtics, normalment localitzats en el retroperitoneu (la zona que es troba darrere de l’abdomen).
- Estadi III: el tumor presenta metàstasi o elevació molt important dels marcadors tumorals.
Pronòstic
Els factors pronòstics són característiques del tumor i del pacient que permeten estimar a priori la seva evolució posterior, complementant l’ estadi marcat pel sistema TNM.
En el càncer de testicle amb metastasi tractat amb quimioteràpia hi ha 3 factors pronòstics de gran importància amb els quals l’ any 1997 es va elaborar una classificació pronòstica d’ enorme abast, encara vigent, i crítica a l’ hora de determinar el tractament més adequat per a cada malalt:
La Classificació Pronòstica de l’International Germ Cell Cancer Collaborative Group (IGCCCG).
Aquesta classificació estableix 3 categories per als tumors no seminomatosos (pronòstic favorable, intermedi o desfavorable); i 2 per als seminomatosos (pronòstic favorable o intermedi; no existeixen pacients amb pronòstic desfavorable en aquest subtipus histològic). Els factors pronòstics són:
- Que el tumor s’origini en el propi testicle (signe de bon pronòstic) o fora d’ell. Un petit percentatge de tumors de cèl·lules germinals poden presentar-se en zones del cos diferents del testicle, sense que es trobi tumor en el propi testicle; bé perquè el tumor inicial ha desaparegut o perquè realment la malaltia es va originar fora del testicle. Això últim pot succeir perquè durant el desenvolupament de l’ embrió el testicle migra fins a la seva posició final en l’ escrot. En aquest trajecte poden quedar restes de cèl·lules del testicle que molt rarament ja en l’edat adulta poden donar lloc a tumors.
- L’absència de metàstasi a distància (M1) (signe de bon pronòstic), amb excepció de les metàstasis de pulmó que per si soles no indiquen mal pronòstic.
- El grau d’ elevació dels marcadors tumorals. En general, com més elevats, el pronòstic és pitjor.
Tractament
Si bé els tumors germinals del testicle tenen molt bon pronòstic en mans experimentades, parlem de neoplàsies de molt ràpid creixement, que suposen una agressió molt important per a l’organisme, i que solen afectar pacients molt joves. És per això que la principal recomanació internacional és que aquests malalts siguin derivats ràpidament a centres especialitzats amb professionals habituats al seu maneig.
Cal tenir en compte que, un cop curats, aquests pacients s’ hauran vist sotmesos a tractaments que minven la seva capacitat reproductiva, i que impacten en la seva esfera sexual i de l’ autoimatge, per la qual cosa hem de preveure aquests detalls des del principi, implicar les seves parelles si n’ hi ha, preservar esperma si escau, i aconsellar adequadament en el moment oportú.
El tractament dels tumors de testicle requereix en primer lloc treure el testicle mitjançant una intervenció quirúrgica anomenada orquiectomia. Aquest és un dels pocs tumors en què, fins i tot si la malaltia s’ha estès a altres òrgans s’ha de treure el tumor original. Les raons són que els tractaments de quimioteràpia arriben malament al testicle i que l’examen del tumor és molt important per determinar les seves característiques i el seu tractament. La cirurgia per treure el testicle sempre s’ha de realitzar a través de l’angle (via inguinal) i no a través de la pell de l’escrot (via transescrotal), ja que altrament augmenten les possibilitats de contaminació del teixit sa per cèl·lules del tumor.
Un cop extirpat el testicle, el tractament es decideix en funció:
- Del tipus de tumor (seminoma o no seminoma): el tractament dels seminomes i dels tumors no seminomatosos en estadis I i II és diferent, però en els estadis III és relativament similar;
- De la seva extensió (estadi I, II o III); y
- De la seva categoria pronòstica (favorable, intermèdia, o desfavorable).
Tot i que aquí es comenten breument els tractaments més habituals.
Tractament d’ acord als diferents estadis
- Estadi I:
Els pacients amb tumors de testicle en estadi I es curen amb el tractament adequat en gairebé el 100% dels casos. Com s’ha comentat prèviament, aquests tumors només afecten el testicle, per la qual cosa en teoria la seva extirpació hauria de ser curativa per si mateixa. El problema és que en un petit percentatge dels pacients la malaltia pot tornar a aparèixer. Per evitar-ho, en alguns casos es pot administrar tractament complementari amb intenció preventiva (tractament adjuvant) que disminueix de forma molt important el risc que la malaltia reaparegui. Els tractaments adjuvants (tant quimioteràpia com radioteràpia) impliquen riscos i poden generar seqüeles.
- Seminoma:
El 80% dels pacients queden curats després de l’orquiectomia, però en un 20% dels casos, la malaltia pot tornar a aparèixer. Per tant, en els pacients amb seminoma estadi I, les alternatives són:
– Administrar quimioteràpia amb 1 o 2 cicles d’ un fàrmac anomenat carboplatí. Aquest tractament és ben tolerat i disminueix el risc de recaiguda a un 3-4%.
– No administrar cap tractament i realitzar observació acurada del pacient. Així s’evita realitzar tractaments innecessaris a pacients que realment no anaven a tenir una recaiguda.
– Tractament amb radioteràpia retroperitoneal. Aquests tumors són molt radiosensibles i la radioteràpia és eficaç per tractar-los. Tanmateix, avui dia aquesta opció terapèutica és menys emprada per les toxicitats tardanes.
- No seminoma:
En els tumors no seminomatosos el 70% dels pacients es curen només amb cirurgia, però en el 30% restant el tumor pot tornar a aparèixer. Avui dia no disposem de factors que ens segreguen bé quins pacients van a recaure i quins no.
En principi, aquells pacients el tumor dels quals envaeix els vasos sanguinis o els vasos limfàtics del testicle tenen més risc que la malaltia reaparegui. En aquest cas podria estar més justificat tractar de forma preventiva amb quimioteràpia mitjançant l’administració de dos cicles amb uns fàrmacs anomenats bleomicina, etopòsid i cisplatí (BEP). No obstant això, amb aquesta estratègia estaríem sobre tractant un percentatge de pacients pròxim al 50% que mai van a recaure després de ser operats.
Els pacients el tumor dels quals no envaeix els vasos sanguinis o limfàtics, tenen menys risc que la malaltia reaparegui i s’hi tendeix a ser menys agressiu i en termes generals es tendeix a fer únicament un seguiment acurat.
Una altra opció és vigilar tots els pacients i no tractar més que aquells en què la malaltia reaparegui per evitar realitzar tractaments innecessaris, com ja comentem anteriorment.
També en els tumors no seminomatosos, en cas que la malaltia reaparegui, tant si s’ha administrat quimioteràpia complementària com si no, el tractament s’adequa a l’escenari de tumor avançat.
- Estadi II:
Els pacients amb estadi II tenen malaltia en els ganglis del retroperitoneu. La majoria d’aquests pacients també es curen amb un tractament adequat.
- Seminoma:
el tractament habitual d’aquests pacients consisteix en quimioteràpia amb 3 cicles de BEP o quatre cicles de cisplatí i etopòsid (EP), que aconsegueixen un resultat equivalent. En alguns pacients, després d’aquests tractaments queden restes dels ganglis limfàtics del retroperitoneu que no desapareixen per complet. Davant d’aquesta situació hi ha dues opcions en funció de la mida de la massa residual (restes del tumor). En aquelles masses residuals majors de 3 cm s’ha de plantejar la realització d’un PET per confirmar o desmentir si hi ha malaltia viable o és només necrosi (cèl·lules mortes) o fibrosi. En lesions residuals menors de 3 cm no cal cap intervenció i n’ hi ha prou amb seguir el pacient de forma rutinària.
- No seminoma:
en aquests pacients, el tractament més habitual és administrar quimioteràpia amb 3 cicles de BEP. També en aquests pacients poden quedar restes dels ganglis limfàtics del retroperitoneu que no desapareixen per complet. En aquests casos, qualsevol lesió residual > 1 cm ha de ser resseguda i analitzada mitjançant una intervenció anomenada limfadenectomia retroperitoneal, que pot ser duta a terme via robòtica, laparoscòpica o oberta. En aquesta intervenció es ressequen els ganglis limfàtics de tot l’espai retroperitoneal, és a dir, els ganglis ubicats al voltant dels grans vasos del cos (espai presacro, espai obturador, ilíaques, aorta, cava, i vasos renals). El PET no s’ ha de fer servir com a mètode diagnòstic en aquest context llevat de situacions molt excepcionals. - Estadi III: En aquests pacients el tractament es realitza de forma similar tant en tumors no seminomatosos com en seminomes. Aquests pacients s’ han de classificar d’ acord amb els criteris de risc que presentin i tractar segons el grup de risc al qual pertanyin.
- Pacients amb pronòstic favorable:
el tractament consisteix en 3 cicles de BEP o 4 d’ EP. - Pacients amb pronòstic intermedi o desfavorable: el tractament consisteix en 4 cicles de BEP. En alguns pacients s’ofereixen altres alternatives, com esquemes de quimioteràpia diferents o quimioteràpia a dosis altes amb suport de progenitors de òssia, ocasionalment en el context d’assajos clínics, amb l’objectiu d’intentar millorar els resultats del tractament.
Seguiment i controls
Després del tractament del càncer de testicle és molt important realitzar revisions periòdiques. Les revisions són més intenses en els pacients amb estadi I en els quals no s’administra tractament complementari després de la cirurgia, perquè el seu risc de recurrència és més gran. En aquests pacients, és freqüent que es realitzin controls cada 2 mesos, o fins i tot cada mes, durant el primer i segon any del diagnòstic.
En les revisions, a més de preguntar pels símptomes i de dur a terme una exploració física, sol realitzar-se una determinació dels marcadors tumorals dels tumors de testicle. A més, de forma periòdica, sol realitzar-se radiografia de tòrax, TAC abdominal i una ecografia de testicle. Segons l’extensió de la malaltia al diagnòstic i els símptomes que presenti el pacient es poden afegir altres proves diferents.
La freqüència de les revisions sol ser variable i la seva durada és un tema de debat.
La realitat és que el major risc que la malaltia reaparegui es dona en els primers 2 anys després del diagnòstic. Transcorreguts els 5 anys [que hoy en día se considera un punto de referencia muy común en oncología] el risc de recaiguda és baix.
Càncer de bufeta
El càncer de bufeta és un tumor molt més freqüent del que de vegades ens transmeten les estadístiques o els mitjans de comunicació. Ocupa el novè lloc pel que fa al nombre de diagnòstics de càncer a nivell mundial., i el cinquè a Europa.
La mitjana d’edat al diagnòstic es troba al voltant dels 70 anys. Curiosament hi ha diferències geogràfiques marcades, sent els tumors de la via urinària molt més freqüents a l’oest europeu (inclosa Espanya) i Amèrica del Nord, que a Àsia o Europa de l’Est.
La majoria d’aquests tumors es diagnostiquen en fases precoces de desenvolupament i es poden curar amb cirurgia més o menys extenses. No obstant això, quan el tumor està més avançat, la curació pot ser més complicada i els objectius del tractament canvien cap a prolongar la supervivència i millorar la qualitat de vida del malalt.
Factors de risc
La principal causa coneguda del càncer de bufeta és el tabac, al qual s’atribueixen al voltant del 50% de tots els casos diagnosticats. El tabac no només afecta la nostra via respiratòria a través del fum. I no només el consum, sinó que l’exposició ambiental al tabac també pot ser considerada com un factor de risc. Més de 60 productes carcinògens continguts en els cigarrets són absorbits i eliminats per l’orina afectant en gran mesura les cèl·lules de la paret de la nostra via urinària.
Hi ha altres factors de risc, però la majoria d’ells no són habituals en el nostre medi. Entre aquests factors s’ inclou la exposició a algunes substàncies químiques d’ús industrial (certs metalls, tints i gomes); l’exposició a fàrmacs com la ciclofosfamida, o l’esquistosomiasi, una infecció produïda per un paràsit que sol trobar-se a l’Àfrica i certes regions d’Amèrica Llatina.
No s’ha demostrat de forma clara que la presència d’antecedents familiars de càncer de bufeta augmenta el risc de desenvolupar la malaltia en altres membres de la mateixa família, tot i que el diagnòstic en pacients menors de 60 anys s’hauria de considerar amb especial atenció.
Prevenció
La millor manera de prevenir el càncer de bufeta és evitar el consum de tabac, atès que com hem comentat és el factor de risc més important per desenvolupar la malaltia.
No es realitzen estudis de forma rutinària en persones sanes per diagnosticar el càncer de bufeta de forma precoç, perquè no hi ha evidència que això sigui realment beneficiós.
Tipus histològics
Els tipus histològics són les diferents classes de tumors que es poden desenvolupar en un òrgan, determinades en funció de les característiques microscòpiques del tumor.
En el cas dels tumors de bufeta el principal tipus histològic és el carcinoma urotelial, les cèl·lules del qual deriven de la mucosa que recobreix per dins la bufeta (epiteli transicional o uroteli). Igual que en altres òrgans, poden aparèixer tumors derivats de moltes altres cèl·lules, incloent-hi el carcinoma escamós (que es forma sobre cèl·lules planes que apareixen a la bufeta quan hi ha irritació de la mateixa), l’adenocarcinoma (tumors que es formen a partir de glàndules), els carcinomes de cèl·lules petites i d’altres encara menys freqüents. En aquest document ens referirem als tumors urotelials, per ser amb molta diferència els més comuns.
Els tumors derivats de la via urinària superior (urèter i pelvis renal) també solen ser urotelials. Són molt similars en el seu comportament biològic al càncer de bufeta i el seu maneig, llevat d’aspectes tècnics concrets, és molt similar.
Simptomatologia
El símptoma principal per sospitar un càncer de bufeta és l’aparició de sang a l’orina (hematúria) sense dolor associat durant la micció. L’aparició de sang a l’orina es pot detectar a simple vista (hematuria macroscòpica) o en una anàlisi d’orina (hematuria microscòpica). Tot i que hi ha diversos processos no tumorals pels quals pot aparèixer sang a l’orina, incloent-hi els càlculs a la via urinària i les infeccions d’orina, l’hematuria és un símptoma important pel qual sempre s’ha de consultar amb un metge.
Els tumors de bufeta també poden donar com a símptomes molèsties urinàries, incloent necessitat d’orinar amb més freqüència i en poca quantitat, dolor o escozor en orinar, o ganes d’orinar just després d’acabar de fer-ho; i tot això sense necessitat de provocar hematuria associada. Aquests símptomes són molt inespecífics, i poden estar presents en altres patologies molt més comunes i de comportament benigne, com la hiperplàsia prostàtica benigna, les infeccions urinàries o la bufeta hiperactiva.
Quan existeixen metàstasi en altres òrgans, aquestes poden produir símptomes molt variats, depenent de la seva localització. Els llocs més freqüents en què apareixen metàstasi del càncer de bufeta són els ossos i el pulmó, tot i que també poden aparèixer al fetge, cervell i gairebé qualsevol òrgan.
Diagnòstic
Quan se sospita un càncer de bufeta, a més de preguntar pels símptomes i explorar el pacient, s’han de realitzar certes proves complementàries per confirmar-ho i per determinar el subtipus tumoral i l’estadi de la malaltia.
- Analítica general de sang: és especialment important controlar la funció del ronyó, perquè en els pacients amb càncer de bufeta amb freqüència està alterada. La funció del ronyó es determina amb una prova analítica anomenada creatinina i filtratge glomerular. A més, l’hematuria pot generar anèmia o altres alteracions que també seran visibles en aquest examen.
- Citologia seriada d’ orina: la presència de cèl·lules urotelials malignes en l’orina detectades mitjançant un estudi citològic confirma el diagnòstic. No obstant això, la citologia d’orina no és gaire sensible, i hi sol haver malalts amb càncer de bufeta sense alteracions destacables en la seva analítica d’orina, sobretot en aquells pacients que es diagnostiquen de tumors de baix grau.
- Ecografia abdominal i de la via urinària (Ecografia reno-vésico-prostàtica): permet observar amb detall els ronyons, urèters i la bufeta sempre que es trobin plens d’orina. És una prova no invasiva i innòcua per al pacient que en molts casos és capaç de detectar els tumors vesicals, i avaluar el seu abast sobre la via urinària o la resta d’òrgans abdominals.
- Cistoscòpia: la cistoscòpia és el mètode “gold estàndard” per al diagnòstic i estadificació local del càncer de bufeta. Consisteix a introduir a la bufeta a través de la uretra un tub flexible equipat amb una petita càmera de vídeo. Això ens permet observar l’interior de la bufeta, i fins i tot es poden realitzar algunes intervencions, com treure pòlips, prendre biòpsies, etc. Es pot realitzar en quiròfan ambulatori, sense necessitat d’ anestèsia general.
- Tomografia axial computada (TAC) del tòrax i/o ressonància nuclear magnètica (RM) de l’abdomen i de la pelvis: sol realitzar-se especialment si hi ha sospita que el tumor hagi avançat fins a capes més profundes de la bufeta. Aquests estudis permeten determinar l’ estadi tumoral.
A més, es poden realitzar en alguns casos:
- TAC o RM cerebral: si se sospita l’ existència de metàstasis cerebrals.
- Gammagrafia òssia: si poden existir metàstasis òssies.
Com a tècnica de diagnòstic i tractament es realitza en tots els casos, llevat d’ excepcions:
- Resecció transuretral de tumor vesical (RTU): consisteix en una operació per poder observar l’interior de la bufeta i realitzar reseccions amb més profunditat, i així estadiar fins a quina capa ha arribat aquest tumor. És una intervenció que requereix anestèsia, però també es duu a terme a través de la uretra i suposa una mínima agressió per al pacient
Estadificació
En general, tots els tumors es classifiquen en diversos estadis (en funció de paràmetres com la seva mida, òrgans afectes, disseminació a distància, etc.) que tindran una evolució diferent i requeriran tractaments diferents. En el cas del càncer de bufeta la classificació més emprada és el sistema TNM, que valora l’extensió del propi tumor (T, tumor primari), els ganglis limfàtics (N, de l’anglès nodes o ganglis) i la presència de metàstasi (M).
De forma senzilla, es distingeixen els estadis següents:
- Tumor vesical no múscul-invasius (TVNMI) o “superficials” :són tumors que no envaeixen la capa externa de la bufeta (capa muscular), tot i que sí que poden envair les capes internes de la bufeta (mucosa o submucosa).
- Tumor vesical múscul-invasiu (TVMI) o “infiltrant”: el tumor envaeix el múscul de la bufeta. Aquest fet implica una possibilitat més gran que s’ estengui a altres parts del cos, produint metàstasi.
- Tumor vesical localment avançat: el tumor envaeix el teixit que envolta la bufeta o envaeix òrgans veïns com la pròstata, l’úter o la vagina.
- Tumor vesical metastàsic: el tumor es troba disseminat afectant els ganglis limfàtics o presenta metàstasi a distància en altres òrgans del cos.
L’estadi de cada cas marca de forma molt significativa l’evolució esperable de cada pacient. No obstant això, no tots els pacients amb un mateix estadi evolucionen de la mateixa manera i, en el curs particular de cada cas, també tindran molta rellevància altres factors pronòstics, tractaments rebuts, característiques del pacient, etc.
Pronòstic
Els factors pronòstics són característiques del tumor i del pacient que permeten estimar a priori la seva evolució posterior, complementant l’ estadi marcat pel sistema TNM.
En els tumors en fases inicials un factor pronòstic important és el grau tumoral. Es diu que un tumor és de baix grau quan, vist el microscopi, s’assembla molt al teixit des del qual es va originar (en aquest cas, el teixit normal que recobreix la bufeta o uroteli); i un grau més alt quan les seves cèl·lules estan tan malmeses i desestructurades que gairebé no s’assemblen en res al teixit original. Actualment els tumors urotelials es divideixen únicament entre alt o baix grau. Els tumors d’alt grau són més agressius i tenen més risc de tornar a aparèixer després del tractament.
Tampoc tots els pacients amb tumors en fases avançades tenen la mateixa evolució. Se sap que els pacients que, quan són diagnosticats, tenen pitjor estat general, anèmia, valors d’albúmina en sang baixos i/o metàstasi a distància viscerals (especialment en fetge) tenen un pitjor pronòstic i es pot esperar una menor supervivència.
Tractament
El tractament dels tumors de bufeta es realitza en funció de l’ estadi que presenten.
- Tumor vesical no múscul-invasius (TVNMI) o “superficials”:
Els pacients amb tumors de bufeta en estadis “superficial” es curen amb el tractament adequat en la majoria dels casos, tot i que tenen un risc alt de tornar a reaparèixer. En funció del grau del tumor i la presència d’ altres factors, el tractament pot consistir únicament a extirpar el tumor mitjançant cistoscòpia o resecció transuretral o, en altres casos, i administrar tractament complementari amb immunoteràpia o quimioteràpia directament dins la bufeta, a través d’ una sonda vesical, mitjançant una o diverses instilacions. Aquests tractaments intravesicals redueixen el risc de recidiva tumoral i de progressió del tumor de “superficial” a infiltrant
- Tumor vesical múscul-invasiu (TVMI) o “infiltrant”:
El principal problema d’aquests pacients és que presenten un risc relativament alt que la malaltia produeixi metàstasi a distància, i per tant, que això afecti la seva supervivència. Existeixen diverses opcions de tractament:
- Cistectomia radical:
consisteix a extirpar la bufeta, òrgans i ganglis limfàtics propers. És el tractament més habitual. Es pot fer via oberta, laparoscòpica o robòtica. El seu major inconvenient és que, en eliminar la bufeta, no és possible orinar de forma normal. Les solucions més freqüentment utilitzades per reconstruir la via urinària són:
- Realitzar una ureteroileostomia o Bricker: consisteix a desviar els urèters a un fragment d’intestí prim (íleon), que desembocarà a la pell, format una ostomia… A aquest orifici (ostomia) es fixa mitjançant un anell adhesiu una bossa de plàstic per recollir l’orina i la bossa es va buidant de forma periòdica.
- Realitzar una neovella: amb teixit de l’intestí prim (íleon) del mateix pacient es realitza una bossa a la qual es connecten els urèters. L’orina arriba fins a aquesta neovellega situada a l’interior de l’abdomen i pot sortir a l’exterior a través la mateixa uretra del pacient que es torna a connectar a la neovella. No sempre és possible realitzar aquesta última tècnica i en alguns casos s’associa a complicacions.
Durant els últims anys, s’estan estandarditzant les tècniques mínimament invasives per al tractament del tumor vesical infiltrant. La cistectomia robòtica ha demostrat que presenta menors complicacions en el postoperatori, amb menor sagnat intraoperatori, menys taxa de transfusió, i menors taxa d’oli paralític. La cistectomia amb robot Da Vinci, al seu torn, ha permès una prompta recuperació del pacient, permetent una disminució de dies d’ingrés hospitalari, atès que les complicacions postoperatòries són menors, mantenint uns resultats oncològics de qualitat. Aquestes tècniques requereixen de gran experiència quirúrgica en aquest àmbit. Per tant, menor agressivitat quirúrgica amb cirurgia robòtica, i un equip expert, donen els millors resultats.
- Tractament conservador de preservació vesical: consisteix a eliminar el tumor evitant treure la bufeta, per augmentar la comoditat del pacient. Aquestes tècniques només es poden realitzar en alguns pacients molt seleccionats tant per la situació de la malaltia, com per la situació del mateix pacient, i han de ser dutes a terme per equips amb experiència i bona coordinació. Quan es realitzen, s’ ha de dur a terme un seguiment molt complet del pacient, per identificar les possibles reaparicions del tumor. Existeixen diverses alternatives:
- Quimiorradioteràpia: els tumors de bufeta són sensibles a la radioteràpia i en alguns casos es poden eliminar amb aquest tractament, que habitualment s’administra de forma simultània amb quimioteràpia.
- Resecció transuretral: en casos excepcionals, quan la invasió tumoral no és gaire profunda, pot ser una alternativa, però no es tracta d’ un maneig estàndard.
- Teràpia trimodal: És l’opció més recomanable en el cas d’ optar per preservació vesical. Consisteix a dur a terme una RTU àmplia que permeti eliminar qualsevol resta tumoral, i a continuació, dur a terme el tractament amb quimio-radioteràpia concomitant.
- Tractament complementari: com s’ha comentat, un dels principals problemes d’aquests tumors és que poden reaparèixer, bé a la zona inicial (recidiva local) o en altres parts del cos (metàstasi). Això passa perquè malgrat el tractament inicial, pot persistir malaltia microscòpica, que no podem detectar en les proves realitzades al diagnòstic. Per intentar disminuir el risc que reaparegui el tumor, es pot administrar tractament complementari amb quimioteràpia. El tractament complementari no sempre s’ administra, depèn de l’ estadi de la malaltia i de les característiques del pacient. El tractament es pot realitzar de dues formes:
- Tractament adjuvant o adjuvació: administració de quimioteràpia després d’ extirpar el tumor. La seva capacitat per disminuir el risc que la malaltia reaparegui no és absoluta, però hi ha dades que en donen suport. Hi ha, a més, alguns assajos clínics en marxa per intentar augmentar el nostre coneixement sobre aquest tema sobre l’ús d’immunoteràpia sistèmica amb inhibidors dels punts de control del sistema immune.
- Tractament neoadjuvant o neoadjuvança: administració de quimioteràpia abans d’ extirpar el tumor. Els resultats d’alguns assajos clínics indiquen que disminueix el risc que torni a aparèixer la malaltia i impacta en la supervivència i evolució a llarg termini d’aquests pacients. El seu principal desavantatge és que retarda l’operació. L’ús d’immunoteràpia sistèmica com a tractament neoadjuvant d’aquests pacients sí que està obtenint resultats prometedors.
- Tumor vesical localment avançat:
El tractament és similar, però sol ser més agressiu i sol consistir en cistectomia radical, radioteràpia o quimiorradioteràpia. Altres tècniques menys agressives com la resecció transuretral o la cistectomia parcial, no solen emprar-se. També s’ ha d’ aplicar tractament complementari amb quimioteràpia o immunoteràpia en la majoria dels casos.
- Tumor vesical metastàsic:
L’objectiu del tractament és controlar o retardar l’aparició dels símptomes i augmentar la supervivència dels pacients. El tractament amb cirurgia, a més de ser més complicat, no aconsegueix la curació de la malaltia, per la qual cosa no sol realitzar-se excepte amb una intenció pal·liativa en casos molt seleccionats. Les opcions de tractament inclouen:
- Quimioteràpia: tradicionalment ha estat el tractament emprat amb més freqüència en aquesta fase de la malaltia tot i que l’arribada de noves alternatives per a aquests pacients està suposant un gran canvi en les guies de maneig clínic d’aquests pacients. Les combinacions de quimioteràpics més actives i per tant desitjables són aquelles que contenen cisplatí. En general sol administrar-se al costat de gemcitabina, però també es fa servir combinat amb metrotexate, vinblastina i adriamicina, o amb gemcitabina més paclitaxel. No obstant això, no tots els pacients resulten bons candidats (“fit”) per ser tractats amb cisplatí. Els malalts amb cert grau d’insuficiència renal, mala situació funcional, hipoacúsia, dany nerviós persistent sobre nervis perifèrics i/o insuficiència cardíaca són considerats no aptes (“unfit”) per rebre tractament amb cisplatí. En aquests casos els agents quimioteràpics tradicionalment emprats han estat combinacions amb carboplatí; tot i que en el moment actual s’hauria de considerar l’ús d’immunoteràpia si el perfil biològic de la malaltia ho permet. Vinflunina o paclitaxel són quimioteràpics fins ara emprats en segona línia, i podrien continuar sent una alternativa per a aquests pacients a tenir en compte en algun moment de la seqüència de tractaments. No obstant això, diversos estudis han demostrat que la immunoteràpia sistèmica amb inhibidors check-point resulta superior a aquests quimioteràpics, en pacients el tractament dels quals en primera línia amb cisplatí ha fracassat.
- Immunoteràpia: l’arribada de la immuno-oncologia és ja una realitat i l’ús dels inhibidors dels check-point del sistema immune ha canviat el tractament del càncer de bufeta. La base d’aquests tractaments és infondre fàrmacs al pacient que modulen la resposta del seu propi sistema immune contra el tumor, de manera que les nostres pròpies defenses siguin capaces d’eliminar les cèl·lules malignes. Cinc fàrmacs diferents d’aquesta famíliapembrolizumab, atezolizumab , nivolumab, durvalumab i avelumab) ja van demostrar ser actius, i en molts casos superiors a la quimioteràpia clàssica, per a aquells pacients amb tumors prèviament ja tractats amb platí, és a dir, en l’ escenari de la segona línia de tractament. També en pacients no prèviament tractats, no candidats a cisplatí, i els tumors dels quals expressin de forma significativament elevada la proteïna “PD-L1”, l’ús d’inhibidors de check-point del sistema immune ha demostrat ser l’opció més apropiada de tractament. Recentment s’han comunicat resultats molt prometedors de la combinació de quimioteràpia juntament amb atezolizumab en primera línia de tractament, de manera que és possible que en un futur pròxim pugui plantejar-se com una realitat per als pacients.
- Teràpia dirigida: els tumors urotelials són neoplàsies que solen albergar múltiples alteracions genètiques subjacents. El coneixement d’ aquestes ens ha permès generar una classificació molecular de diferents subtipus de càncer de bufeta. D’altra banda, aquests avenços han permès desenvolupar drogues inhibidores d’alteracions genètiques concretes (com erdafatinib per al cas de les mutacions en el gen FGFR; o altres fàrmacs relacionats amb la via de PTEN o MTOR) els resultats de la qual en càncer de bufeta estan resultant molt positius i probablement puguin utilitzar-se a curt termini per al tractament d’aquests malalts.
- Immunoconjugats: es tracta de compostos que uneixen un agent de quimioteràpia a un anticòs específicament dirigit contra una diana específica del tumor. D’aquesta manera, es vehiculitza la quimioteràpia contra la neoplàsia incrementant la seva activitat i evitant la seva toxicitat en no actuar sobre teixits sans. Enfortumab-Vedotin és un clar exemple d’un immunoconjugat molt eficaç en càncer de bufeta, per la qual cosa és possible que s’incorpori en un futur no llunyà a les alternatives de tractament avui vigents per a càncer urotelial.
- Radioteràpia: pot emprar-se de forma pal·liativa per tractar alguns símptomes de difícil control com dolor, sagnat important per l’orina, etc….
Seguiment
Després del tractament del càncer de bufeta és molt important realitzar revisions periòdiques. Les revisions en els pacients en què no s’extirpa la bufeta, solen incloure cistoscòpia i citologies seriades d’orina per detectar les possibles recaigudes en la pròpia bufeta al més aviat possible.
En les revisions, a més de la recollida de símptomes i de l’exploració física, sol realitzar-se de forma periòdica alguna prova d’imatge incloent radiografia de tòrax, TAC abdominal i de tòrax o ecografia d’abdomen i de vies urinàries. Segons l’extensió de la malaltia en el moment del diagnòstic i els símptomes que presenti el pacient, s’hi poden afegir altres proves diferents.
Càncer de pròstata
El càncer de pròstata és una malaltia que es desenvolupa principalment en varons d’edat avançada. Sol ser asimptomàtic excepte en estadis avançats de la malaltia.
El càncer de pròstata és el més freqüent de tots els càncers entre els varons.
Factors de risc
- Edat: l’edat és el principal factor de risc per al càncer de pròstata. El risc de desenvolupar un càncer de pròstata comença a augmentar a partir dels 50 anys en homes de raça blanca i a partir dels 40 anys en homes de raça negra o amb història familiar (pare o germà) de càncer de pròstata. Gairebé dos de cada tres casos de càncer de pròstata es detecten en homes majors de 65 anys.
- Raça: el càncer de pròstata és més freqüent en homes de raça negra que en homes d’ altres races. A més, els homes de raça negra tenen una major probabilitat de ser diagnosticats en una etapa avançada, i tenen més del doble de probabilitat de morir de càncer de pròstata en comparació amb els homes blancs. D’altra banda, la taxa més baixa de càncer de pròstata s’observa en individus de raça asiàtica.
- Història familiar: el risc de càncer de pròstata està fortament influenciat per la història familiar. Aquells homes que tenen un familiar de primer grau (pare o germà) diagnosticat de càncer de pròstata tenen més probabilitat de desenvolupar la malaltia. Tan sols un 5-10% dels càncers de pròstata tenen un component hereditari. En el càncer de pròstata hereditari l’edat d’aparició del càncer és més precoç (abans de 55 anys) i sovint els pacients tenen familiars de primer grau afectes de càncer de pròstata. S’han descobert gens implicats en una major susceptibilitat al desenvolupament d’un càncer de pròstata.
- Dieta: recents estudis suggereixen que el consum elevat de greixos animals pot augmentar el risc de patir càncer de pròstata.
Prevenció
S’han estudiat diversos factors que puguin prevenir l’aparició de càncer de pròstata. Cap d’ells , ja siguin suplements dietètics, fàrmacs, activitat física o sexual, es pot actualment recomanar com a factor demostrat en la prevenció del càncer de pròstata.
Símptomes
En les primeres fases, quan el tumor està limitat a la pròstata, pot ser asimptomàtic o acompanyar-se de símptomes obstructius lleus atribuïbles a una hiperplàsia benigna (disminució del calibre o interrupció del raig d’orina; augment de la freqüència de la micció, sobretot nocturna; dificultat per orinar o escozor durant la micció), atès que pot coexistir el càncer de pròstata i la hipertròfia benigna de la pròstata.
Quan els tumors són localment avançats s’acompanyen de símptomes obstructius clars, a més hi pot haver hematuria (sang a l’orina) o signes d’infecció (aquests dos últims són poc freqüents).
Quan es tracta de tumors avançats pot aparèixer edema o figa de cames (a causa del creixement de ganglis limfàtics regionals), dolors ossis (per extensió tumoral a l’os) i fins i tot debilitat o pèrdua de força en cames (compressió de la espinal).
Diagnòstic
Per al diagnòstic s’ utilitza l’ examen físic i les proves complementàries.
- Tacte rectal: consisteix en un examen del recte mitjançant el qual el metge insereix un dit dins d’ un guant lubricat al recte i palpa la pròstata a través de la paret rectal a la recerca de nòduls o àrees anormals. La glàndula prostàtica es troba immediatament davant del recte, i la majoria dels càncers comencen a la part posterior de la glàndula, cosa que es pot palpar durant un examen del recte. Aquest examen és incòmode, però no és dolorós i porta molt poc temps realitzar-lo…
Determinació dels nivells en sang de PSA (PSA total i quocient de PSA): prova de laboratori que mesura les concentracions d’aquest marcador (Proteïna Específica de la Pròstata) en sang. És una substància produïda específicament per la pròstata que es pot trobar en major quantitat a la sang dels homes que tenen càncer de la pròstata. No obstant això, cal tenir en compte que els nivells de PSA també es pot elevar en una infecció o una inflamació de la pròstata com la hiperplàsia prostàtica benigna (augment de mida de la pròstata d’origen no cancerós). L’screening amb PSA, tot i que ha estat un tema controvertit en el món científic urològic, ha demostrat un benefici en augmentar els casos diagnosticats, disminuint les morts atribuïdes a pacients no diagnosticats. Pacients amb PSA < 10 ng/ml tenen 70-80% de probabilitat que la malaltia estigui localitzada, si els nivells de PSA oscil·len entre 10-50 ng/ml el 50% estaran localitzats, si el PSA és > 50 ng/ml tan sols un 25% estaran localitzats.
- Ressonància nuclear magnètica (RM): procediment en què s’utilitza un imant, ones de ràdio i una computadora per crear una sèrie de fotografies detallades de zones internes del cos. A causa dels últims avenços en la classificació PIRADS, s’ ha convertit en una prova fonamental, útil per al diagnòstic i necessàries per a la realització de biòpsies de pròstata per fusió d’ imatges. D’ altra banda, és útil en l’ avaluació de l’ extensió del tumor dins de la pelvis.
Biòpsia prostàtica
Normalment es realitza guiada per ecografia transrectal. Quan hi ha sospita de càncer, cal extreure una petita quantitat de teixit prostàtic per examinar-la al microscopi. Aquesta prova permetrà confirmar el diagnòstic de càncer i ens donarà idea del volum tumoral i el grau d’agressivitat (puntuació Gleason).
- Gleason 6: tumors de baix grau
- Gleason 7: tumors de grau intermedi
- Gleason 8-10: tumors indiferenciats
Biòpsia prostàtica per fusió d’imatges
La Biòpsia per fusió és una tècnica que permet fusionar en temps real les imatges de la RM prostàtica amb l’ ecografia transrectal, la qual cosa permet localitzar exactament la zona nodular sospitosa dins de la pròstata i, per tant, millor precisió en el diagnòstic de càncer de pròstata, en permetre la punció exacta d’ aquesta zona sospitosa.
Estadificació
Sense tractament, la supervivència del càncer de pròstata depèn de l’edat al diagnòstic, estat general de salut, grau tumoral i estadi al diagnòstic.
Entre els pacients no tractats amb càncer de pròstata localitzat, els que tenen una baixa puntuació de Gleason (6) tenen molt baix risc de morir del seu càncer en els pròxims 15 anys (4-7%) independentment de l’edat del pacient en el moment del diagnòstic; no obstant això, els que tenen un tumor indiferenciat amb Gleason 8-10, tenen una major probabilitat de morir del seu càncer davant d’altres causes, encara que el diagnòstic sigui en edats avançades.
El procés que s’empra per definir si el càncer s’ha estès dins de la pròstata o a altres parts de l’organisme s’anomena estadificació. És important conèixer l’ estadi o etapa de la malaltia per tal de planificar el tractament. Per descartar afectació òssia, es realitza la gammagrafia òssia, i per descartar l’afectació visceral o adenopàtica, s’utilitza la tomografia axial (TAC).
Models predictius
Utilitzen el PSA, la puntuació de Gleason i l’estadi T per predir la probabilitat que el pacient estigui lliure de malaltia després del tractament local, de manera que els pacients poden incloure’s dins de 3 grups pronòstics:
- Baix risc: T1-T2a, Gleason 6 i PSA < 10 ng/ml. Més del 85% dels pacients estan lliures de malaltia als 5 anys del tractament amb cirurgia o radioteràpia.
- Risc intermedi: T2b i/o Gleason 7 i/o PSA 10-20. El 50-70% estaran lliures als 5 anys.
- Alt risc: T3 o superior o Gleason 8-10 o PSA > 20. Tan sols el 33% romandran lliures de malaltia després del tractament local.
Tractament
Existeixen tres estratègies considerades estàndard per al maneig del càncer de pròstata localitzat:
- Cirurgia
- Radioteràpia amb/sense hormonoteràpia
- Vigilància activa
L’ elecció del tractament depèn de diversos factors:
- La probabilitat que el tumor estigui limitat a la glàndula prostàtica i per tant sigui potencialment curable.
- La mida tumoral i el grau histològic (grau d’agressivitat del tumor).
- Edat del pacient i estat general, així com malalties associades.
- Potencials efectes secundaris de les diferents formes de tractament.
Avaluació pretractament
Abans de triar la millor opció terapèutica és primordial que l’ extensió de la malaltia estigui correctament avaluada.
Els més importants factors per predir l’evolució de la malaltia abans del tractament són l’estadi, el nivell de PSA en sang, el volum tumoral (nº de biòpsies positives i percentatge del material obtingut en la biòpsia que està afectat pel tumor) i el grau d’agressivitat del tumor, referit com a puntuació de Gleason.
Cirurgia: prostatectomia radical (PR)
Consisteix a extreure completament la glàndula prostàtica i les vesícules seminals. Existeixen 3 maneres de realitzar-la: per via oberta, per via laparoscòpica o per via robòtica.
La Prostatectomia per Robot DaVinci, és la tècnica menys invasiva i amb més precisió que existeix per a l’extirpació prostàtica. En aquesta cirurgia, s’introdueixen uns tròcars a l’abdomen del pacient, en els quals s’acoblen els braços robòtics, que el cirurgià controla des d’una consola externa integrada., El fet que el Robot Da Vinci permeti una visió tridimensional real, associat al fet que els braços permetin realitzar tots els graus de moviment dins de l’abdomen del pacient, són els principals avantatges d’aquesta tècnica, respecte a la tècnica oberta i laparoscòpica. La Prostatectomia Robòtica, gràcies a aquests avantatges, permet un millor postoperatori immediat, així com una disminució en la taxa d’Incontinència urinària i disfunció estèctil. El fet que sigui un procediment tan precís permet preservar l’ esfínter urinari de manera íntegra, amb la qual cosa disminueixen de manera molt significativa les taxes d’ incontinència urinària, així com preservar les bandetes neurovasculars, la qual cosa ocasionarà menor impacte durant el postoperatori pel que fa a la disfunció ericent o impotència.
Al seu torn, permet realitzar limfadenectomies esteses, és a dir, extirpació de ganglis limfàtics, en aquells casos que es requereixin.
La Prostatectomia Laparoscòpica 3D, és una tècnica mínimament invasiva, que ha evolucionat durant els últims anys. De la mateixa manera que en la prostatectomia per robot, permet una extirpació de tota la glàndula, tot i que la capacitat de preservar les estructures implicades en la continència urinària i en la funció erèctil, no és tan precisa.
Ambdues tècniques permeten un bon control de la malaltia oncològica.
Actualment la prostatectomia radical oberta està en desús, a causa de les seves comorbilitats.
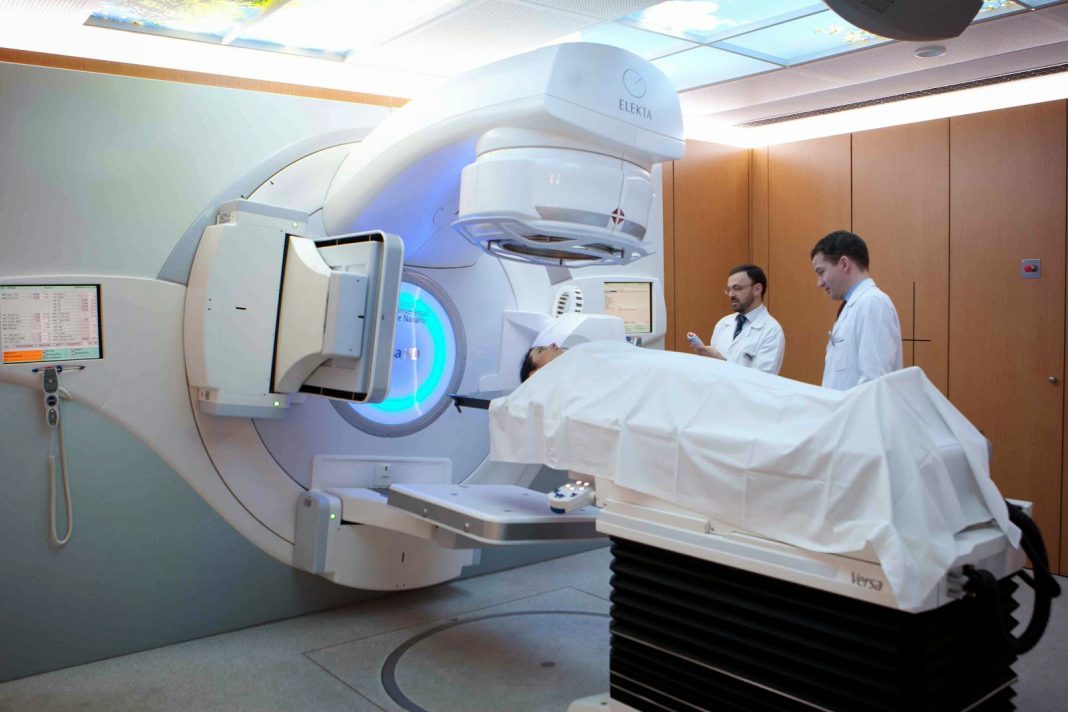
Radioteràpia (RT)
S’utilitzen dues formes de RT per tractar el càncer de pròstata:
- Radioteràpia externa
- Braquiteràpia o RT d’ implantació intersticial
Radioteràpia externa:
utilitza una màquina anomenada accelerador lineal que es mou al voltant del pacient dirigint la radiació a la pelvis. S’administra a diari (5 dies a la setmana) durant 4 a 7 setmanes (depèn de si s’utilitza sola o en combinació amb braquiteràpia). No requereix hospitalització.
Complicacions de la RT: són conseqüència de la petita quantitat de radiació que reben els teixits sans propers al tumor (bufeta i recte, sobretot); amb els nous avenços tecnològics s’han anat minimitzant cada vegada més. Les més freqüents són:
- Augment de la freqüència miccional i sensació d’ urgència miccional
- Dolor en orinar
- Impotència, en aquest cas més freqüent a mesura que transcorre temps des de la RT.
- Problemes intestinals (diarrea, dolor i sagnat, els dos últims secundaris a la inflamació produïda en el recte denominada proctitis)
Per tal de reduir els efectes secundaris de la radioteràpia externa clàssica, s’ han anat millorant les tècniques d’ afinació i existeixen avui dia noves formes d’ administrar la radiació que no estan disponibles en tots els centres:
- RT conformada o tridimensional (RTC-3D): s’ha
convertit en tractament estàndard després de la publicació de nombrosos estudis clínics. Permet administrar dosis més altes a la pròstata, respectant els teixits que estan al voltant, per tant, disminueix la taxa d’ efectes secundaris, sobretot els problemes intestinals. - RT d’intensitat modulada (IMRT):
permet variar (escalar) la dosi de RT i la intensitat durant la teràpia. Redueix els efectes secundaris i facilita el tractament quan cal incloure els ganglis limfàtics pèlvics al camp. Permet administrar dosis molt elevades (81 Gy) amb poca toxicitat intestinal. Aquesta tècnica no està disponible en tots els centres pel seu cost elevat. - Braquiteràpia o RT d’ implantació intersticial:
consisteix a administrar una font radioactiva dins la pròstata guiada per ecografia. Avantatges: es realitza en un temps curt i precisa poca estada hospitalària. Les sèries publicades semblen indicar que és un bon tractament només per a pacients amb tumors de baix risc.
Complicacions de la braquiteràpia: ocasiona una síndrome urinària aguda (de curta durada) provocada per la inflamació de la pròstata, que fins i tot pot provocar retenció aguda d’orina. Provoca menys incontinència que la RT externa, menys problemes a nivell del recte. El risc d’impotència és similar al dels altres tractaments.
- Radioteràpia guiada per la imatge (IGRT): permet també l’administració de dosis més altes de radioteràpia externa (fins i tot arribar fins a 90Gy) mitjançant la utilització de tècniques d’imatge avançada com la ressonància magnètica amb espectroscòpia…
Vigilància activa
És una opció vàlida en certs casos com pacients que presenten tumors petits, amb baix Gleason, lent ascens dels nivells de PSA, i imatges en la ressonància que no demostrin progressió. Per tant, és indicat en aquells pacients que tenen tumors de baix risc
No és una opció adequada per a pacients amb tumors de risc intermedi o alt risc, és a dir, pacients amb tumors grans, Gleason alt, en els quals el creixement tumoral és ràpid i per tant tenen una alta probabilitat de morir a causa del seu càncer de pròstata.
El protocol de vigilància activa permet tenir controlats aquells pacients que té un càncer de pròstata de baix risc, Durant el seguiment, es realitzen controls seriats de PSA, habitualment cada 4-6 mesos, així com Ressonàncies Magnètiques de pròstata seriades, habitualment anuals, i Biòpsies prostàtiques també seriades, anuals o bianuals, per descartar la progressió de la malaltia. En el cas que la malaltia progressi, es realitzarà un tractament actiu.
Aproximadament el 50% dels pacients que estan en observació passen a rebre tractament dins dels tres primers anys ja sigui per progressió o per l’ansietat de romandre sense tractament.
Tractament hormonal: supressió androgènica
La pròstata és un òrgan dependent en el seu creixement del nivell d’hormones masculines, anomenades andrògens (el més important dels andrògens és la testosterona).
La supressió o deprivació androgènica consisteix a aplicar tractaments que aconsegueixin disminuir al màxim els nivells de testosterona en l’ organisme, amb això s’ ha observat que disminueix la mida tant de la pròstata normal com de la pròstata tumoral.
En diferents estudis s’ha comprovat que afegir tractament hormonal abans o després del tractament local (RT) millora els resultats en pacients de risc intermedi i alt, no així en pacients de baix risc.
La durada del tractament és controvertida, normalment el tractament s’inicia 1 o 2 mesos abans i es prolonga fins a 6 mesos (casos de risc intermedi) o fins a 2 anys (alt risc) amb les dades disponibles fins a la data.
Els efectes secundaris del tractament de supressió androgènica són: disminució del desig sexual, impotència, sofocs, creixement del teixit mamari que pot ser dolorós, debilitat muscular, pèrdua de massa òssia amb risc augmentat de fractures, anèmia i un major risc de desenvolupar diabetis o malaltia coronària.
Crioteràpia
És un tractament local que aconsegueix destrucció de les cèl·lules tumorals mitjançant aplicació de congelació en la glàndula prostàtica.
S’aplica sota anestèsia local en quiròfan i encara que els resultats són prometedors, no hi ha dades disponibles a llarg termini, per tant, no pot ser recomanada com a tractament estàndard en el càncer de pròstata localitzat com ho són la cirurgia o la RT. Pot ser útil en cas de reaparició del tumor després de RT o cirurgia prèvia.
Teràpies focals
Dins dels tractaments alternatius que es poden aplicar a pacient amb càncer de pròstata de baix risc són els tractaments coneguts com a teràpies focals… Aquests tractaments poden ser fonamentalment HIFU, tot i que també hi ha tractaments com la teràpia fotodinàmica, electroporació, crioteràpia focal.
Fonamentalment l’HIFU (Ultrasons d’alta freqüència), permet, després de localitzar la zona a tractar basat en les imatges de ressonància magnètica i biòpsia prostàtica per fusió, realitzar un tractament focal, només a la zona afectada pel tumor. Aquestes teràpies actualment són considerades en fase 1, tot i que hi ha cert perfil de pacients que se’n podrien beneficiar.
Càncer de pròstata avançat
Aproximadament un 15-20% dels pacients amb càncer de pròstata es presenten en el moment del diagnòstic en fase avançada, és a dir, el tumor s’ha estès més enllà de la glàndula envaint òrgans veïns per continuïtat (càncer de pròstata localment avançat que correspon a tumors T3, T4 de la classificació TNM) o bé afecta els ganglis limfàtics regionals (estadis III) i fins i tot envaeix altres òrgans a distància (càncer de pròstata metastàsic o estadi IV).
D’altra banda, els pacients que en una fase inicial presenten tumors localitzats, poden presentar recurrència o recaiguda de la seva malaltia, tractant-se llavors també d’una malaltia avançada.
Tractament del càncer de pròstata localment avançat (T3, T4)
Les opcions de tractament recomanades inclouen:
- RT externa amb o sense braquiteràpia
- Resecció transuretral (RTU) de la pròstata
- Prostatectomia radical
- Teràpia hormonal basada en supressió androgènica: normalment en combinació amb cirurgia i RT.
Cirurgia
- Prostatectomia radical (PR): com hem dit abans, consisteix a extreure completament la glàndula prostàtica. Es realitzen dins d’una modalitat que es denomina “tractament multimodal”. Atès que la malaltia no està només localitzada dins de la pròstata, es proposa realitzar després de la cirurgia, tractament amb RT, o combinació de RT més HT, en funció de les característiques del tumor després d’ extreure la pròstata. Això ens permet disminuir la taxa de recidiva local. Es pot realitzar la prostatectomia radical amb robot també en pacients amb càncer de pròstata localment avançat
Radioteràpia
- RT externa: Es considera una altra alternativa en els pacients amb tumors localment avançats són tractats amb RT externa en combinació amb tractament de supressió androgènica. Pel que fa a la durada òptima del tractament hormonal hi ha controvèrsia: s’ ha d’ iniciar dos mesos abans de la RT i la durada oscil·la entre 6 mesos i 2-3 anys.
- RT externa + braquiteràpia: com hem vist abans la braquiteràpia consisteix a administrar una font radioactiva dins la pròstata guiada per ecografia. La seva utilitat en tumors localment avançats és en combinació amb RT externa. Aquesta opció té un temps de durada de 4-5 setmanes davant les 8 de la RT externa però no és recomanable en cas de símptomes urinaris molt pronunciats.
Supressió androgènica
Com hem dit anteriorment la supressió androgènica consisteix a aplicar tractaments que aconsegueixin disminuir els nivells de testosterona en l’ organisme, amb això s’ ha observat que disminueix la mida tant de la pròstata normal com de la pròstata tumoral. També és un tractament que actua contra les cèl·lules tumorals que han sortit fora de la pròstata produint metàstasi.
Es pot aconseguir reduir al màxim els nivells de testosterona de diverses maneres:
- Mitjançant una cirurgia anomenada orquiectomia que consisteix a extirpar els testicles (on hi ha la major font d’andrògens del cos).
- Mitjançant fàrmacs que actuen sobre l’ hormona que regula la quantitat d’ andrògens que produeixen els testicles. Els més empleats són: goserelina, leuprorelina, triptorelina, buserelina. Tots ells s’ administren mitjançant injecció.
- Mitjançant fàrmacs anomenats antiandrògens: actuen sobre els receptors d’ andrògens. Els més utilitzats són flutamida i bicalutamida que són fàrmacs d’administració oral. Aquests fàrmacs per si sols no disminueixen suficientment els nivells de testosterona i en general, han de ser emprats en combinació amb els anteriors.
En pacients amb càncer de pròstata localment avançat la deprivació androgènica rara vegada s’utilitza com a única estratègia, ja que no obté els mateixos resultats que la cirurgia o la RT quant a control local del tumor.
Efectes secundaris del tractament hormonal:
disminució del desig sexual, impotència, sofocs, creixement del teixit mamani que pot ser dolorós, debilitat muscular, pèrdua de massa òssia amb risc augmentat de fractures i un major risc de desenvolupar diabetis o malaltia coronària.
Tractaments de pacients amb elevació del PSA després de la teràpia local
Quan en el seguiment de pacients tractats de càncer de pròstata localitzat i en fase precoç es detecta una elevació mantinguda dels nivells de PSA en sang en absència de símptomes, sovint amb els mètodes diagnòstics disponibles no podem detectar metàstasi. Llavors parlem de recidiva bioquímica. En aquests casos és fonamental estadiar bé la situació del tumor, amb exploracions complementàries com el TAC abdominal, la gammagrafia òssia, el PET-colina o el PET-PSMA, Aquesta situació representa una categoria del càncer de pròstata avançat en la qual hem de tenir en compte certes consideracions:
- Alguns d’aquests pacients encara poden ser curables amb una teràpia local addicional.
- El temps mitjà que triga el tumor a donar signes de malaltia disseminada (com són les metàstasis òssies) és fins a vuit anys i en algunes ocasions no hi ha mai progressió simptomàtica.
No obstant això, molts pacients, tot i que estan asimptomàtics, presenten grans nivells d’ansietat en veure que els nivells de PSA augmenten progressivament.
El millor tractament en aquesta situació depèn de diversos factors:
- En pacients que han estat tractats prèviament amb RT es pot plantejar una prostatectomia de rescat si la recaiguda es limita a la pròstata i el creixement tumoral no és ràpid. El temps que tarden els nivells de PSA a multiplicar-se x 2 es denomina temps de doblament del PSA i ens dóna una idea del creixement tumoral. Doncs bé, quan aquest temps de doblament és inferior a 3 mesos, hem de considerar altres opcions diferents a la cirurgia.
- Pacients tractats inicialment amb cirurgia radical poden ser rescatats de forma exitosa amb RT. No obstant això, el tractament local no és el recomanat en la majoria dels casos a causa de l’alta probabilitat que el tumor s’hagi estès més enllà de la pròstata, tot i que no puguem detectar-ho amb els mètodes diagnòstics disponibles. En aquest sentit, el PET-turó pot ser d’ utilitat en un intent de localitzar el focus de recidiva.
- Per a pacients no candidats a cirurgia o RT ens queden dues opcions: teràpia hormonal (basat en deprivació androgènica) o bé observació.
Quan iniciar el tractament hormonal en recidiva bioquímica sense símptomes?
Les raons a favor d’iniciar un tractament precoç en absència de símptomes serien:
- Retardar la progressió de la malaltia i disminuir la taxa de complicacions com ara l’obstrucció urinària i les metàstasis doloroses.
- Hi podria haver un benefici en supervivència, sobretot en pacients amb malaltia mínima. No demostrat en estudis fins a la data.
- Molts pacients no accepten diferir el tractament mentre els nivells de PSA continuen augmentant en cada determinació.
Les raons a favor d’ esperar i iniciar tractament quan existeixin signes de la malaltia són:
- Els efectes secundaris indesitjables que minven clarament la qualitat de vida del pacient i el seu entorn familiar.
- L’ elevat cost del tractament.
El pacient ha de ser informat del benefici / risc d’ambdues opcions i participar amb el seu especialista en la decisió a prendre, i de manera ideal, després de presentar el seu cas en un comitè uro-oncològic amb experts en càncer de pròstata, tant uròlegs, com oncòlegs mèdics i oncòlegs radioterapeutes.
Càncer de pròstata metastàsic
Tractament de primera línia
Una part dels pacients amb càncer de pròstata recauen en forma de malaltia avançada després del tractament local (radioteràpia o prostatectomia radical) i, d’altra banda, hi ha una minoria de pacients que presenten malaltia disseminada o estesa ja des del diagnòstic.
Quan el càncer s’ha estès més enllà de la glàndula prostàtica la supressió androgènica és l’estratègia de tractament usualment recomanada.
Existeixen diverses opcions disponibles per aconseguir disminuir o eliminar els nivells d’ andrògens:
- Orquiectomia: cirurgia que consisteix a extirpar els testicles (on hi ha la major font d’andrògens del cos).
- Injeccions d’agonistes de la LHRH: són fàrmacs que actuen sobre l’hormona que regula la quantitat d’andrògens que produeixen els testicles. Els més emprats són: goserelina (Zoladex®), triptorelina (Decapeptyl®), buserelina (Suprefact®), leuprorelina (Procrin®, Eligard®). S’ administren mitjançant injecció mensual, trimestral o fins i tot semestral.
- Bloqueig androgènic complet: combinació d’agonistes LHRH amb antiandrògens que actuen sobre els receptors d’andrògens, els més usats són bicalutamida (Casodex®) i flutamida (Eulexin®). Aquesta opció comporta majors efectes secundaris indesitjables, a més de ser més costosa. D’altra banda, aconsegueix un modest benefici en supervivència (1-5% als 5 anys).
El tractament en monoteràpia amb andrògens s’associa amb una menor taxa de disfunció sexual i també produeix menys pèrdua de massa òssia. No obstant això, no pot ser considerada una forma de tractament estàndard per al càncer de pròstata i el seu ús hauria d’ estar restringit a casos molt seleccionats com tumors de baix grau o bé malaltia metastàtica de poc volum.
El bloqueig hormonal intermitent s’ha estudiat com a alternativa per millorar la qualitat de vida dels pacients que precisen tractament hormonal. Consisteix a retirar el tractament durant un període de temps, permetent així que el pacient recuperi la funció sexual, almenys temporalment. Normalment es retira el tractament un cop aconseguida la màxima resposta i es reinicia de nou quan els nivells de PSA s’eleven per sobre d’un determinat nivell (10-20 ng/ml). Tanmateix, hi ha un estudi que suggereix que aquesta estratègia és discretament inferior al bloc continu.
Dos grans estudis comunicats recentment refreden el paper de la quimioteràpia amb docetaxel associada a la teràpia de supressió androgènica. Ambdós estudis conclouen que els pacients amb càncer de pròstata metastàsic que reben 6 cicles de docetaxel en règim trisetmanal, a més de la teràpia amb anàlegs LHRH, aconsegueixen supervivències entre 10 i 17 mesos superiors amb un bon perfil de tolerància, una magnitud de benefici que no s’havia observat fins a la data en cap tumor sòlid amb l’addició d’un agent quimioteràpic. Per tant, la quimioteràpia amb docetaxel s’ha de recomanar als pacients amb càncer de pròstata metastàsic associada al tractament inicial amb anàlegs LHRH, especialment als pacients amb malaltia metastàtica d’inici “de novo”, amb gran volum tumoral (més de 4 focus de metàstasi òssies o presència de metàstasi en pulmó o fetge) i sempre que tinguin bon estat general i no presentin contraindicacions per a la mateixa.
La majoria dels pacients responen a una primera maniobra hormonal, però també pràcticament tots progressen al tractament, sobretot dins dels primers dos anys. En aquesta etapa, són considerats tumors resistents a la castració, és a dir, la supressió androgènica sola és ineficaç com a tractament. No obstant això, els pacients poden respondre a altres agents hormonals.
Tractament de segona línia
Pràcticament tots els pacients amb càncer de pròstata avançat desenvolupen tard o d’hora resistència al tractament hormonal de supressió androgènica, evolucionant doncs, cap a l’estat de càncer de pròstata resistent a la castració (CPRC) definit com el càncer que progressa tot i mantenir nivells de testosterona en sang en rang de castració (< 50 mg/dl). Aquests pacients són candidats a rebre tractament sistèmic de rescat i són diverses les opcions disponibles avui dia: nous fàrmacs hormonals, quimioteràpia o agents dirigits a l’os.
Tractaments amb inhibidors del receptor androgènic
L’acetat d’abiraterona és un fàrmac d’administració oral que impedeix la síntesi d’andrògens tant a nivell dels testicles, com de la glàndula suprarenal, com del mateix tumor de pròstata i ha estat àmpliament investigat en el tractament del càncer de pròstata en diferents estadis.
En un estudi aleatoritzat, més de 1.000 pacients amb càncer de pròstata resistent a la castració metastàsic (CPRCm), en tractament previ amb un o dos règims de quimioteràpia, almenys un d’ells amb docetaxel, els pacients tractats amb acetat d’abiraterona combinada amb una dosi de prednisona o prednisolona van presentar una millora important en la supervivència global davant els pacients tractats amb prednisona o prednisolona més placebo. El tractament amb acetat d’abiraterona va aconseguir una reducció d’un 35% en el risc de mort i un augment en la supervivència mitjana (14,8 mesos enfront de 10,9 mesos) en comparació amb el tractament basat en placebo.
Dades recentment publicades confirmen també el benefici en supervivència global de
abiraterona en combinació amb prednisona
en pacients amb càncer de pròstata resistent a castració metastàsic asimptomàtics o amb mínims símptomes que no han rebut prèviament quimioteràpia amb docetaxel, a més d’aconseguir un avantatge en la supervivència sense progressió radiològica, un retard en la necessitat de quimioteràpia o en la necessitat d’analgèsics opiacis.
Abiraterona té un bon perfil de tolerància, destacant com a efectes més freqüents la retenció de líquids, la hipertensió arterial i la disminució de nivells de potassi en sang; com a efectes menys freqüents el fàrmac pot elevar els enzims hepàtics en l’analítica i podria provocar dany cardíac en una minoria de pacients.
Al nostre país, l’abiraterona en combinació amb prednisona està indicat i comercialitzat per al tractament del càncer de pròstata resistent a castració metastàsic de pacients que han progressat al tractament amb docetaxel i de pacients que no han rebut quimioteràpia prèvia, sempre que estiguin asimptomàtics o amb poc dolor.
Enzalutamida és un nou fàrmac del grup dels antiandrògens molt més potent i eficaç que bicalutamida, també d’administració oral, que a diferència d’abiraterona, no necessita l’administració concomitant de prednisona.
Un estudi fase III multicèntric internacional va aleatoritzar una mica més de 1.000 pacients amb CPRC metastàsic que havien progressat al tractament previ amb docetaxel, a rebre enzalutamida o bé placebo, els pacients tractats amb el fàrmac van tenir una supervivència mitjana de 18,4 mesos comparat amb 13,6 mesos per als tractats amb placebo. Això es tradueix en una reducció del 37% en el risc de mort.
Recentment s’han comunicat les dades actualitzades de supervivència d’enzalutamida enfront de placebo en pacients amb CPRC metastàsics asimptomàtics o amb pocs símptomes que no han estat tractats amb quimioteràpia prèvia, confirmant un benefici en la supervivència global, en la supervivència sense progressió i en el temps fins a la necessitat de quimioteràpia.
Enzalutamida té també un bon perfil de tolerància, destacant com a efectes més freqüents el cansament, la diarrea que sol ser lleu i intermitent, el dolor muscular, la cefalea i la hipertensió arterial.
Enzalutamida està indicat i comercialitzat per al tractament del càncer de pròstata resistent a castració metastàsic de pacients que han progressat al tractament amb docetaxel i de pacients que no han rebut quimioteràpia prèvia, sempre que estiguin asimptomàtics o amb poc dolor, fins i tot en pacients que presenten metàstasis viscerals (fetge o pulmó).
Tant abiraterona com enzalutamida presenten interaccions amb altres fàrmacs a tenir en compte i atès que la indicació d’ambdós fàrmacs és per a malaltia metàstasica, és molt important monitoritzar la presència de símptomes associats a la malaltia, especialment la progressió de dolor. Malgrat el bon perfil de tolerància, els pacients que reben aquests tractaments han de realitzar controls estrets pel seu especialista.
Quimioteràpia
La quimioteràpia ja es va mostrar als anys 90 efectiva com a tractament pal·liatiu del càncer de pròstata. Les diverses combinacions de fàrmacs citotòxics estudiades aconseguien una resposta biològica (reducció del PSA) en més del 50% dels pacients, amb una durada de la resposta al voltant de 6 mesos.
Dos estudis aleatoritzats a finals dels 90 van demostrar benefici clínic amb un esquema que combinava dos fàrmacs: mitoxantrone i prednisona comparat amb prednisona sol, però sense millorar la supervivència. L’any 2004, es van publicar els resultats de dos estudis aleatoritzats que per primera vegada van demostrar benefici en la supervivència global amb esquemes de quimioteràpia que contenen docetaxel davant l’esquema clàssic de mitoxantrone-prednisona (considerat estàndard fins a aquesta data).
En tots dos estudis, la supervivència assolida per als pacients tractats amb dotzetaxel assoleix els 17-18 mesos, a més, redueix un 20-24% el risc de mort, augmenta significativament la resposta de PSA, millora significativament el dolor i la qualitat de vida dels pacients. L’efecte secundari més important que provoca és el descens en el recompte de glòbuls blancs que és causa de major susceptibilitat a les infeccions, altres efectes adversos que ocasiona són: caiguda dels cabells, nàusees, diarrea, retenció de líquids, alteracions en les ungles, fatiga i debilitat, entre d’ altres.
La combinació docetaxel-prednisona ha estat considerada fins avui dia tractament estàndard del càncer de pròstata resistent a castració metastàsic.
Fins a l’any 2010 no existia cap tractament amb eficàcia demostrada en estudis clínics controlats per als pacients en els quals dotzetaxel havia fracassat, la combinació mitoxantrone-prednisona era la més utilitzada fins fa uns anys en aquest grup de pacients (en segona línia de tractament).
Un estudi publicat el 2010 demostra que un nou agent quimioteràpic del grup dels taxans anomenat cabazitaxel combinat amb prednisona, aconsegueix una millora estadísticament significativa en supervivència global davant l’esquema clàssic de mitoxantrone-prednisona (15.1 mesos enfront de 12.7 mesos). Els efectes secundaris més freqüents d’aquest nou tractament van ser la diarrea i el descens en el recompte de glòbuls blancs que provoca més susceptibilitat a les infeccions. Amb aquests resultats, aquest fàrmac va ser el primer que es va aprovar al nostre país per a la indicació de tractament del càncer de pròstata resistent a castració que ha progressat a quimioteràpia amb docetaxel.
Tractaments dirigits a l’os
Radio-223 és un nou agent del grup dels radiofàrmacs que s’ ha d’ administrar al Servei de Medicina Nuclear. El fàrmac ha demostrat millorar la supervivència davant placebo (14.9 vs 11.3 mesos) en pacients simptomàtics amb carcinoma prostàtic avançat amb metàstasis òssies que ja havien rebut prèviament quimioteràpia amb docetaxel o bé que no eren elegibles per a aquest tractament. Ràdio-223 va aconseguir una reducció del risc de mort del 31%. A més d’aquest benefici en supervivència, l’administració del fàrmac va prolongar el temps fins al primer esdeveniment ossi i no va afegir toxicitat ressenyable en comparació amb placebo. S’ administra de forma intravenosa en 6 dosis amb un interval mensual entre dosis. Recentment, el Radio-223 ha obtingut la indicació a Espanya de tractament per al càncer de pròstata resistent a la castració amb metàstasis òssies simptomàtiques en pacients que no presenten metàstasis viscerals.
Tractaments que milloren la qualitat de vida
Hi ha altres opcions de tractament disponibles que milloren els símptomes associats a la malaltia i han de ser aplicats en combinació amb els tractaments específics del tumor (hormonoteràpia i quimioteràpia) per millorar la qualitat de vida dels pacients.
Els medicaments contra el dolor o analgèsics (des d’aspirina fins als opioides) són molt eficaços. Quant a la possible addicció o dependència amb fàrmacs opioides gairebé mai és un problema si es prescriuen en pacients amb dolor de gran intensitat. En són efectes secundaris indesitjables la somnolència i l‘ estrenyiment, però habitualment es poden manejar ajustant les dosis o agregant altres medicaments per alleujar aquests efectes.
Els bifosfonats són un grup de medicaments que pot ajudar a alleujar el dolor d’ossos causat quan el càncer que s’ha estès (metàstasi òssies). A més, els bifosfonats ajuden a enfortir els ossos en els pacients que reben teràpia hormonal (prevenció de l’osteoporosi) i també són eficaços en la prevenció de complicacions esquelètiques (dolor, fractures patològiques, compressió de la espinal i necessitat de cirurgia o radioteràpia sobre l’os) en pacients amb càncer de pròstata resistent a castració amb metàstasis òssies.
El bifosfonat més usat és l’àcid zoledrònic, que s’administra mitjançant injecció intravenosa de curta durada (15 minuts) ajustant la dosi a la funció renal del pacient.
Els bifosfonats poden ocasionar efectes secundaris, incloent-hi símptomes semblants a la grip, dolor als ossos 24 hores després de la infusió i un efecte secundari poc comú, però molt molest, és l’osteonecrosi de l’os mandibular (s’até el reg sanguini d’una àrea a l’os i aquesta part de l’os mor). Això pot causar pèrdua de dents i infeccions o ferides obertes de l’os de la mandíbula que no cicatritzin. L’única manera eficaç de tractar aquesta complicació és suspendre l’administració del medicament i administrar fàrmacs per alleujar els símptomes. Es presenta més sovint després de realitzar manipulació dental com extracció d’una dent o mola mentre el pacient rep tractament amb bisfosfonats.
Denosumab és un anticòs monoclonal dirigit davant una proteïna clau en la progressió de les metàstasis òssies; s’administra via subcutània una vegada al mes i té un efecte en la prevenció d’esdeveniments esquelètics (fractures patològiques, radioteràpia o cirurgia sobre l’os i compressió medul·lar) associats a les metàstasis òssies de diferents tumors sòlids, entre els quals es troba el càncer de pròstata resistent a castració.
En un estudi aleatoritzat, denosumab comparat amb àcid zoledrònic va retardar significativament l’ aparició del primer esdeveniment ossi i va reduir tant el primer esdeveniment com els següents.
Tant denosumab com àcid zoledrònic estan indicats en el tractament del càncer de pròstata resistent a castració amb metàstasis òssies per prevenir els esdeveniments ossis associats a la malaltia metastàtica; cap dels dos fàrmacs ha demostrat incrementar la supervivència dels pacients, però, sí que contribueixen a millorar la qualitat de vida. No hi ha evidència científica que justifiqui la utilització periòdica mensual d’àcid zoledrònic en pacients amb càncer de pròstata avançat en fase hormonosensible i sembla que el seu ús prolongat (més enllà de dos anys) augmenta les possibilitats de patir una osteonecrosi mandibular.
Denosumab és superior a àcid zoledrònic en la prevenció d’esdeveniments ossis amb l’avantatge que no necessita ajustar la dosi a la funció renal del pacient, tot i que la taxa d’osteonecrosi mandibular que provoca és discretament superior a la de l’àcid zoledrònic i amb un major cost econòmic.
Prevenció de l’ osteonecrosi mandibular:
revisió dental i tractar qualsevol problema que es detecti abans de començar el tractament. Mantenir una bona higiene oral i sotmetre’ s a exàmens dentals regularment.
Càncer renal
El càncer de cèl·lules renals (també anomenat càncer de ronyó) és una malaltia en la qual es troben cèl·lules malignes o canceroses que s’originen en el revestiment dels túbuls del ronyó (a l’escorça renal).
El càncer de cèl·lules renals és responsable d’un 2-3% de tots els tumors malignes en l’adult. És dues vegades més freqüent en homes que en dones. És més freqüent en afroamericans que en raça caucasiana. La majoria dels casos es diagnostica entre la 4a i la 6a dècada de la vida (a partir dels 50 anys d’edat), però es pot presentar a qualsevol edat.
Factors de risc
El càncer de cèl·lules renals es presenta més freqüentment de forma esporàdica (sense antecedents familiars) i rares vegades forma part d’una síndrome hereditària (5% dels casos).
No s’han determinat les causes exactes d’aquesta malaltia, però, l’hàbit tabàquic (dobla el risc de desenvolupar aquesta malaltia), l’exposició a certs productes químics (cadmi, asbestos, petroli) l’obesitat, la malaltia quística renal adquirida en pacients sotmesos a diàlisi crònica (30% d’aquests pacients) i l’ús indiscriminat d’analgèsics (aspirina i fenacetina, en aquest cas més implicats en el desenvolupament de càncer de vies urinàries), s’associen amb un increment en la incidència d’aquesta malaltia.
Hi ha diverses síndromes hereditàries que associen càncer renal de diferents tipus histològiques amb un altre tipus de tumors. En general, aquells pacients amb un familiar de primer grau diagnosticat de càncer renal abans dels 40 anys i els que presenten càncer renal bilateral o multifocal en un mateix ronyó poden tenir un component hereditari. Cal recordar que tan sols un 5% dels tumors renals que es diagnostiquen formen part d’una síndrome hereditària, la immensa majoria són esporàdics.
Classificació
El carcinoma de cèl·lules renals representa un 80-85% de tots els tumors malignes renals. Típicament s’ origina a l’ escorça renal i presenta diversos subtipus. Aquí descrivim els subtipus més freqüents o rellevants:
- Carcinoma de cèl·lules clares (80%) és el més freqüent. Les cèl·lules clares poden tenir un creixement que varia de lent (grau 1) fins ràpid (grau 4). En aquest tipus de càncer renal s’han validat els resultats de la teràpia dirigida i la immunoteràpia.
- Carcinoma papilar (15%). Es divideix en dues subclasses: tipus 1 i tipus 2 (aquest últim de comportament més agressiu), es tracten actualment de la mateixa manera que el carcinoma de ronyó de cèl·lules clares.
- Carcinoma cromòfob i oncocitoma (5%), aquest últim és de creixement molt lent i rara vegada té capacitat per disseminar-se.
- Carcinoma dels conductes col·lectors (<1%), es comporta de manera similar al carcinoma de cèl·lules transicionals de bufeta i vies urinàries.
- Variant sarcomatoide: pot coexistir amb qualsevol dels subtipus anteriors i comporta un comportament més agressiu del tumor pel seu creixement local més ràpid i invasiu. S’anomena sarcomatoide perquè en examinar-lo amb el microscopi s’assembla al sarcoma.
El nefroblastoma o tumor de Wilms és un altre tipus de càncer renal que es presenta típicament en la infància.
L’angiomiolipoma és un tumor benigne que té un aspecte característic en la tomografia computada (TAC). Tendeix a créixer i no sol disseminar-se, es pot manejar de forma conservadora, embotida o amb cirurgia parcial renal.
Simptomatologia
El càncer renal és fonamentalment asimptomàtic, per la qual cosa sol ser una troballa casual en realitzar proves (ecografies o TAC) per altres motius. Molts pacients no experimenten cap símptoma fins que la malaltia s’ha estès a altres òrgans. . S’ha descrit com a típica l’associació d’hematuria (sang a l’orina), massa i dolor en costat, però aquesta triple associació tan sols és present en un 10% dels casos. L’hematuria apareix en més de la meitat dels casos, però pot no ser visible i tan sols evidenciar-se en una anàlisi d’orina (hematuria microscòpica).
L’anèmia, febre i pèrdua de pes són relativament freqüents en aquest tipus de tumors, quan estan en situacions avançades de la malaltia.
Menys freqüents són la policitèmia (augment en la xifra d’hemoglobina) i la hipercalcèmia (aquesta última ha d’obligar-nos a descartar una extensió del tumor als ossos).
Diagnòstic
Per al diagnòstic es realitza una avaluació completa del malalt, auxiliant-nos en proves complementàries.
- Homologació física i antecedents: és important sempre explorar el pacient per verificar l’ estat general de salut i identificar qualsevol signe de malaltia, com masses, bonys o qualsevol altre signe que sembli inusual. També s’interroga el pacient sobre els seus hàbits, antecedents de malalties i tractaments rebuts. És important investigar també antecedents de càncer en la família.
- Analítica de sang: es demanen diversos perfils analítics que orienten sobre l’ estat global de salut i activitat de la malaltia.
- Analítica d’ orina: prova per determinar el contingut en sucre, proteïnes, la presència o no de sang i bacteris.
- Ecografia abdominal: útil per identificar masses renals i distingir si són de naturalesa quística o sòlides.
- Tomografia amb contrast (TAC): és el procediment d’elecció; es tracta d’un procediment mitjançant el qual es fan una sèrie d’imatges detallades de l’interior del cos, des d’angles diferents. És útil per detectar i avaluar masses renals, si hi ha infiltració de la vena cava inferior, així com si hi ha extensió als ganglis limfàtics regionals.
- Ressonància magnètica (RMN): en el cas que existeixi sospita de trombosi o infiltració de la vena cava inferior, aquesta tècnica ens pot ajudar a avaluar l’extensió d’aquesta infiltració.
- Arteriografia renal: menys utilitzada avui dia amb l’ adveniment d’ altres tècniques com la ressonància; útil per definir la vascularització del tumor renal i per tant en l’ avaluació prèvia a la cirurgia.
- Gammagrafia òssia (GGO): per descartar extensió als ossos en cas de sospita clínica per dolor o elevació de la fosfatasa alcalina o dels nivells de calci en l’analítica.
- Biòpsia o punció-aspiració amb agulla fina (PAAF): extracció de cèl·lules o teixits realitzada perquè un patòleg els observi sota un microscopi i determini la presència o no de cèl·lules tumorals. Per dur a terme una biòpsia del càncer de cèl·lules renals, s’insereix una agulla prima en el tumor i s’extreu una mostra de teixit.
- PET-TAC: amb la tecnologia més recent es poden fer una PET i una TAC alhora (PET/CT scan). Això li permet al radiòleg localitzar amb més precisió anatòmica les àrees de major captació (que suggereixen una àrea de càncer) en el PET, encara que no es tracta d’una tècnica estàndard i només s’ha de fer servir en casos seleccionats. La seva utilitat és més gran en altres tipus de càncers.
Estadificació
Per a l’ estadificació s’ utilitza el sistema TNM. En resum, els estadis clínics basats en aquest sistema són:
- Estadi I: el tumor mesura 7 centímetres o menys i es troba limitat al ronyó.
- Estadi II: el tumor mesura més de 7 centímetres i es troba limitat al ronyó.
- Estadi III: el tumor envaeix la glàndula suprarenal situada just damunt del ronyó o la capa de teixit gras que envolta el ronyó o els vasos sanguinis principals del ronyó (com la vena cava) i pot envair els ganglis limfàtics abdominals.
- Estadi IV: el càncer s’ha estès a altres òrgans com els intestins, el pàncrees, els pulmons, el fetge o els ossos, provocant metàstasi a distància.
Pronòstic
La història natural del càncer de cèl·lules renals és molt variable, i depèn de en quin moment s’ha fet el diagnòstic. Aproximadament un 30% dels pacients es presentaran com a malaltia disseminada o metastàtica en el moment del diagnòstic i un terç dels restants desenvoluparan metàstasi al llarg de la seva evolució.
El pronòstic i les opcions de tractament depenen bàsicament de dos factors:
- L’estadi de la malaltia: a mesura que avança l’estadi (d’I a IV), menors són les possibilitats de curació.
- L ‘ edat del pacient i el seu estat general de salut.
En la malaltia avançada o metastàtica els nivells d’hemoglobina, neutròfils, plaquetes i calci en sang, conjuntament amb l’estat general i el temps transcorregut des del diagnòstic, són factors que classifiquen els pacients en tres grups de risc pronòstic (criteris de Motzer):– —
– Grup de bon pronòstic. – Grup pronòstic intermedi. – Grup de mal pronòstic.
Tractament
Hi ha diferents tipus de tractament disponibles per als pacients amb càncer de cèl·lules renals.
Alguns tractaments són estàndard (el tractament d’ús actual), i d’altres s’estan provant en assajos clínics. Un assaig clínic de tractament és un estudi dirigit a ajudar a millorar els resultats dels tractaments actuals o d’obtenir informació sobre nous tractaments per als pacients amb càncer.
Quan els assajos clínics mostren que un tractament nou és millor que el tractament estàndard, el nou tractament es pot convertir en el tractament estàndard.
Estadí |
Tractament |
| Estadis I i II | Nefrectomia radical o parcial amb o sense limfadenectomia Crioablació o ablació per radiofreqüència |
| Estadi III | Nefrectomia radical amb limfadenectomia regional |
| Estadi IV | Nefrectomia citorreductora Resecció de metàstasi Tractaments sistèmics: • Immunoteràpia • Antiangiogènics • Inhibidors mTOR • Quimioteràpia Radioteràpia pal·liativa Bifosfonats |
Cirurgia
Quan la malaltia es presenta localitzada al ronyó la cirurgia pot ser potencialment curativa i en principi s’ ha d’ oferir als pacients amb estadis I, II o III.
Per tractar el càncer de cèl·lules renals es pot utilitzar una intervenció quirúrgica que extirpa part del ronyó o tot el ronyó. Existeixen els següents tipus de cirurgia:
- Nefrectomia radical: procediment quirúrgic que extreu el ronyó, la glàndula suprarenal (actualment només s’extirpa en cas de sospita d’infiltració), el teixit del voltant i, en general, alguns ganglis limfàtics propers. De vegades s’han de ressecar també part d’òrgans adjacents en cas que el tumor estigui adherit. Normalment es realitza mitjançant laparoscòpia, cirurgia robòtica o per cirurgia oberta. És potencialment curativa
- Nefrectomia parcial: procediment quirúrgic per extreure el tumor i part del teixit que l’ envolta per tal de conservar teixit renal sa i funcionant. Es pot realitzar una nefrectomia parcial per evitar la pèrdua de la funció renal quan l’ altre ronyó està malmès o ja s’ ha extirpat, també en cas de tumors bilaterals i ha de ser considerada la tècnica d’ elecció quan el tumor és menor de 7 cm, ja que conserva millor la funció renal. La nefrectomia parcial es pot realitzar per via laparoscòpica i robòtica. En casos molt comptats caldria recórrer a la cirurgia oberta.
Una persona pot viure amb només una part d’un ronyó que funcioni, però si s’extirpen els dos ronyons o si no estan funcionant, la persona necessitarà diàlisi (procediment per netejar la sang mitjançant una màquina exterior al cos) o un trasplantament de ronyó (substituir el ronyó malalt per un ronyó sa donat).
La crioablació i l’ablació per radiofreqüència: són altres alternatives per al tractament local del tumor en cas de no ser viable la nefrectomia parcial per diverses raons (condició mèdica del pacient). L’objectiu és destruir el tumor mitjançant congelació (crioablació) o mitjançant alta energia (radiofreqüència). Són útils només en cas de tumors de petita mida, i pacients amb importants comorbilitats que impedeixen realitzar el procediment quirúrgic.
Cirurgia en càncer renal avançat (estadi IV): l’opció de cirurgia per a pacients amb malaltia disseminada o estesa té com a objecte reduir el major volum de massa tumoral possible (cirurgia citorreductora) i és útil en alguns pacients que són candidats a rebre posteriorment tractament amb immunoteràpia o amb teràpia dirigida, sobretot en aquells considerats com a grup de bon pronòstic i de pronòstic intermedi. . No és una opció vàlida per a pacients amb múltiples localitzacions metastàsiques i mal estat general.
Cirurgia de metàstasi: la cirurgia de metàstasi pot ser útil en casos molt seleccionats, especialment en metàstasis pulmonars de poc volum i de petita mida, o també en el cas de metàstasi suprarenals.
Cirurgia renal mínimament invasiva (Laparoscòpia, retroperitoneoscòpia i robòtica)
Amb la intenció de minimitzar l’agressió quirúrgica i de millorar la recuperació post-quirúrgica, van néixer les tècniques de nefrectomia total o parcial laparoscòpica i robòtica per al tractament del càncer renal.
La nefrectomia parcial laparoscòpica i la nefrectomia parcial robòtica Da Vinci han demostrat menor sagnat intraoperatori, millor recuperació de la funció renal, menor ingrés hospitalari i més ràpida recuperació i reinici de vida laboral.
En casos que existeixin cirurgia abdominals prèvia o en casos que el tumor estigui situat a la cara posterior del ronyó, la tècnica d’ elecció és la nefrectomia parcial per Retroperitoneoscòpia, és a dir, accedint al ronyó des de l’ esquena i el costat, no des de l’ abdomen. En aquests casos, la recuperació és molt ràpida, disminueix el sagnat i el temps operatori, així com l’estada hospitalària
Radioteràpia
En càncer renal, la radioteràpia sobre el tumor primari es considera una opció de tractament pal·liativa, és a dir, no curativa i es pot considerar en alguns casos amb malaltia localitzada al ronyó i condicions mèdiques desfavorables per sotmetre’s a una cirurgia. En cas d’ afectació dels marges de resecció quirúrgics es podria utilitzar com a tractament complementari a la cirurgia, tot i que aquesta estratègia no sembla clarament demostrada en els estudis clínics.
Per tant, en el càncer renal, el paper de la radioteràpia queda reservat a pal·liar símptomes derivats de les metàstasis òssies.
Tractament mèdic
Quan es tracta d’un càncer renal avançat, la cirurgia no és curativa i per tant es recomana un tractament amb fàrmacs que actuïn globalment i arribin a tots els òrgans del cos (tractament sistèmic) amb la finalitat d’aconseguir remissió de la malaltia o impedir-ne la progressió. El càncer de cèl·lules renals recidivat és un càncer que ha reaparegut després d’haver estat tractat i pot reaparèixer al ronyó o en altres parts del cos, fins i tot anys després del tractament inicial. En aquells casos en què la malaltia recau o bé progressa després de la cirurgia, hem de proposar també un tractament sistèmic. En casos seleccionats de recaiguda única es pot considerar la cirurgia de rescat si és factible.
En el tractament previ a la cirurgia o complementari després d’ ella no s’ ha de considerar un tractament sistèmic a data d’ avui, de forma estandarditzada.
Quimioteràpia
En general, el càncer de cèl·lules renals, a diferència d’un altre tipus de tumors, és resistent a quimioteràpia. Per tant, necessitem altres estratègies terapèutiques.
Immunoteràpia i tractament inhibidor de “check-point” cel·lular
És un tipus de teràpia biològica que estimula la capacitat del sistema immune per combatre el càncer. S’ empren substàncies produïdes pel cos o fàrmacs elaborats en un laboratori per estimular, dirigir o restaurar les defenses naturals del cos contra la malaltia.
Diverses estratègies basades en immunoteràpia s’han utilitzat per augmentar la immunitat antitumoral. L’ administració de citoquines clàssiques com a Interleukina 2 (IL-2) i Interferó α (IFNα), té eficàcia clínica demostrada des de la dècada dels 80, però avui dia el seu ús a la clínica ha disminuït considerablement a causa de l’eficàcia de nous tractaments diana que han demostrat més eficàcia clínica i millor perfil de tolerància.
D’altra banda, han aparegut nous fàrmacs basats en inhibidors de receptors cel·lulars “check-point” com són PDL-1 (programmed death 1 checkpoint) i CTLA-4. Aquests fàrmacs són Nivolumab, Ipilimumab, Pembrolizumab, Avelumab. Quan es bloquegen aquests receptors, aconseguim una resposta immunitària mantinguda contra les cèl·lules tumorals
Teràpia dirigida
La teràpia dirigida utilitza fàrmacs i altres substàncies que poden identificar i eliminar cèl·lules canceroses específiques sense danyar les cèl·lules normals. Són els fàrmacs anomenats teràpies diana. Aquests fàrmacs poden produir remissió de la malaltia o bé impedir-ne la progressió en la majoria dels casos però no curen la malaltia.
La teràpia antiangiogènica és un tipus de teràpia dirigida per al càncer avançat de cèl·lules renals amb resultats molt consolidats en els últims anys. Actua sobre receptors crítics dels vasos sanguinis desenvolupats en el propi tumor. Amb aquest tipus de teràpia s’impedeix la formació de nous vasos sanguinis per part del tumor que són imprescindibles perquè aquest es nodreix i així seguir avançant; el resultat és que el tumor deixa de créixer o redueix la seva mida.
Entre els fàrmacs antiangiogènics, els millors resultats s’han aconseguit amb Sunitinib, Pazopanib, Tivozanib, Bevacizumab, Sorafenib, Axitinib i recentment Cabozantinib.
Els anomenats inhibidors de la via mTOR que és una via que té un paper fonamental en el metabolisme, creixement, i proliferació de la cèl·lula tumoral, han demostrat activitat en aquesta malaltia en estudis aleatoritzats i actualment disposem de dos fàrmacs: Temsirolimus i Everolimus.
Aquestes combinacions han demostrat eficàcia en primera línia o en el tractament d’ entrada per a la malaltia avançada:
- Axitinib-Avelumab
- Axitinib-Pembrolizumab
- Nivolumab-Ipilimumab
- Sunitinib
- Pazopanib
- Tivozanib
- Bevacizumab-interferon
- Temsirolimus en pacients amb criteris de mal pronòstic
En segona línia o després de fallada al tractament d’ entrada:
- Nivolumab
- Cabozantinib
- Axitinib
- Everolimus
- Sorafenib
Existeixen altres fàrmacs com el Lenvatinib o altres combinacions (Cabozantinib-Nivolumab,…) pendents d’arribar en els pròxims anys amb resultats prometedors.
Tractament simptomàtic
A més del tractament específic de la malaltia és important el maneig de símptomes en càncer renal. Per alleujar el dolor, a més de fàrmacs analgèsics, és útil la radioteràpia com a tractament pal·liatiu.
En el cas de les metàstasis òssies també és útil la utilització de fàrmacs del grup dels bifosfonats (Zometa® -àcid zoledrònic-) que ajuden a disminuir les complicacions derivades de l’afectació tumoral a l’os.
Càncer de via urinària superior: pelvis renal i urèter
L’urèter és l’estructura tubular prima que connecta el ronyó amb la bufeta. La pelvis renal i els urèters estan revestits de cèl·lules de la capa transicional i a partir d’aquestes cèl·lules es genera la major part dels càncers de via urinària superior (75 al 85%).
És important recordar que el 90% dels tumors de cèl·lules transicionals se situa a la bufeta. Únicament el %-10% es localitza en el tracte urinari superior, per la qual cosa també es denominen carcinoma urotelial de la via urinària superior. O tumor de via urinària. Els de la pelvis renal doblen en freqüència els presentats a l’urèter.
Altres tipus histològics són el carcinoma epidermoide (15 a 20%), que s’associa a litiasis urinàries i infeccions recurrents, i l’adenocarcinoma (6-8%).
Aquest càncer és diferent del càncer renal.
Els tumors primaris de la pelvis renal són relativament poc freqüents, constituint el 7-8% de tots els tumors renals en l’ésser humà. La major freqüència passa entre la sisena i setena dècades de la vida i poden ser benignes, però en general són malignes. És més freqüent en homes, en una proporció molt heterogènia segons els estudis epidemiològics que s’ han dut a terme: 1.7-4.2: 1.
Factors de risc
Els factors de risc per al càncer de cèl·lules de transició de pelvis renal i d’urèter són els següents:
- Tenir antecedents personals de càncer de bufeta.
- Tabaquisme.
- Consum crònic d’analgèsics, com la fenacetina (paracetamol).
- Estar exposat a certes tintures i substàncies químiques utilitzades en la fabricació de productes de cuir, tèxtils, plàstics i cautxú.
Simptomatologia
Els símptomes més comuns són: hematuria (80-90%), dolor en flanc (24-37%) i irritació vesical (15-20%).
Vies de disseminació
El càncer es pot disseminar per la sang, el sistema limfàtic i la sang:
- Per contigüitat. El càncer s’estén cap a les àrees properes, com a altres àrees de l’urèter, la bufeta, òrgans adjacents (glàndules suprarenals, còlon, intestí prim) o la paret abdominal.
- Sistema limfàtic. Es pot estendre a través dels vasos limfàtics i arribar als ganglis.
- Sang. També es pot disseminar a través dels vasos sanguinis i establir-se després en qualsevol òrgan del cos.
Diagnòstic
En el diagnòstic del càncer transicional de pelvis renal i urèter s’ utilitzen procediments no invasius i invasius:
- Examen físic i antecedents de salut: s’examina l’estat general de salut i s’identifica qualsevol signe de malaltia, com masses o qualsevol altra cosa que sembli anormal. També es prenen dades sobre els hàbits de salut, els antecedents de malalties i els tractaments anteriors
- Ureteroscòpia: s’ observa l’ interior de l’ urèter i la pelvis renal i serveix per detectar àrees sospitoses que requereixen biòpsia. S’introdueix un ureteroscopi a través de la uretra per arribar fins a la bufeta, l’urèter i la pelvis renal. De vegades, es passa un instrument a través de l’ureteroscopi per prendre biòpsies o mostres de teixit i analitzar-les al microscopia la recerca de signes de malaltia.
- Citologia d’ orina: prova per comprovar les característiques cel·lulars. De vegades, es desprenen cèl·lules canceroses dels càncers del ronyó, bufeta o urèter que passen a l’orina. El rang de positivitat per a aquest tipus de tumors varia entre el 60 al 65% per als tumors de via superior.
- Tomografia computada (TC): procediment per al qual es pren una sèrie d’imatges detallades de l’interior del cos des d’angles diferents. Les imatges es creen amb una computadora connectada a una màquina de raigs X. S‘ injecta un contrast iodat en una vena o s’ ingereix per tal que els òrgans o els teixits es destaquin de forma més clara. Té un alt rendiment diagnòstic que varia entre 78-92% per al càncer de pelvis i urèter.
- Ecografia: procediment per al qual es fan rebotar ones de so d’alta energia (ultrasòniques) en els teixits o òrgans interns per tal de produir ecos. Els ecos formen una imatge dels teixits del cos que s’anomena ecograma. Es pot fer una ecografia de l’abdomen per ajudar a diagnosticar el càncer de pelvis renal i d’urèter.
- Ressonància magnètica (RM): procediment per al qual fa servir un imant, ones de ràdio i una computadora per tal de crear una sèrie d’imatges detallades d’àrees de l’interior del cos, com la pelvis.
- Biòpsia: extracció de cèl·lules o teixits perquè un patòleg els observi al microscopi i determini si hi ha signes de càncer. Aquest procediment es pot realitzar durant una ureteroscòpia o una cirurgia.
Estadificació
Per a l’ estadificació, a banda dels estudis diagnòstics ja esmentats, es pot ordenar:
- Tomografia per emissió de positrons (TEP): procediment per trobar cèl·lules de tumors malignes al cos. S’injecta en una vena una quantitat petita de glucosa radioactiva (sucre). El TEP trenca al voltant del cos i crea una imatge dels llocs del cos que fan servir la glucosa. Les cèl·lules de tumors malignes es veuen més brillants en la imatge perquè són més actives i absorbeixen més glucosa que les cèl·lules normals. El rendiment és baix per a aquest tipus de cel·lularitat tumoral.
- Gammagrafia òssia: procediment per verificar si hi ha cèl·lules als ossos que es multipliquen ràpid, com les cèl·lules canceroses, a l’os. S’ injecta una quantitat molt petita de material radioactiu en una vena i aquest ressegueix el torrent sanguini. El material radioactiu s’acumula als ossos amb càncer i es detecta amb un escàner. Es realitzen en aquells casos en què hi hagi sospita simptomàtica de metàstasi òssia.
Amb aquestes proves diagnòstiques es pot classificar la malaltia dins d’ un estadi determinat:
Estadi 0 (carcinoma papil·lar no invasor i carcinoma in situ): en aquest estadi es troben cèl·lules anormals en el teixit que revesteix l’interior de la pelvis renal o l’urèter. És possible que aquestes cèl·lules anormals es tornin canceroses i es disseminen al teixit normal proper. L’ estadi 0 es divideix en els estadis 0a i 0is segons el tipus de tumor:
- L’estadi 0a també s’anomena carcinoma papil·lar no invasor, que de vegades té l’aspecte de bonys allargats i prims que sobresurten del teixit que revesteix l’interior de la pelvis renal o l’urèter.
- L’estadi 0is també s’anomena carcinoma in situ; és un tumor pla en el teixit que revesteix l’interior de la pelvis renal o l’urèter.
Estadi I: el càncer es va dissecuinar des del teixit que revesteix l’interior de la pelvis renal o l’urèter fins a la capa de teixit conjuntiu.
Estadi II: el càncer es va dissecundar a la capa muscular de la pelvis renal o l’urèter.
Estadi III: el càncer es va dissecuinar:
- des de la capa muscular de la pelvis renal al greix que envolta la pelvis renal o al teixit del ronyó; o
- des de la capa muscular de l‘ urèter al greix que envolta l’ urèter.
Estadi IV: el càncer es va dissecundar almenys un dels següents llocs:
- un òrgan proper.
- la capa de greix que envolta el ronyó.
- ganglis limfàtics.
- a altres parts del cos, com el pulmó, el fetge o l’ os.
Els estadis 0, I i II es presenten en la majoria dels pacients diagnosticats (55 a 65%) amb una sobrevida a 5 anys que va del 87 al 100%. Alguns investigadors troben que la supervivència a 5 anys per als estadis III i IV varia entre 12 a 50%.
A més, el càncer de pelvis renal i d’ urèter pot classificar-se com a localitzat, regional, metastàsic o recidivant:
- Localitzat: el càncer es troba només al ronyó.
- Regional: el càncer es va dissecuinar als teixits que envolten el ronyó, als ganglis limfàtics propers i els vasos sanguinis de la pelvis.
- Metastàsic: el càncer es va dissecundar a altres parts del cos.
- Recidivant: el càncer va recidivar (va tornar) després del tractament. És possible que el càncer reaparegui a la pelvis renal, la uretra o altres parts del cos, com els pulmons, el fetge o els ossos.
Tractament
Les opcions de tractament depenen dels aspectes següents:
- L’ estadi i el grau del tumor.
- El lloc on hi ha el tumor.
- Si l’altre ronyó del pacient està sa.
- Si el càncer va recidivar.
Cada vegada s’estan duent a terme protocols de tractament menys invasius, amb l’objectiu de preservar la unitat renal i oferir una millor qualitat de vida als pacients. Això gràcies a l’adveniment d’importants avenços tecnològics en endourologia i a l’entrenament exhaustiu dels nostres especialistes.
Tractament estàndard
Procediments endourològics conservadors de l’òrgan (Tractament endoscòpic amb làser del tumor de via urinària superior)
Fulguració làser: és un procediment quirúrgic que destrueix el teixit mitjançant un fes làser. La cirurgia es duu a terme mitjançant ureterorrenoscòpia o accés percutani, és a dir, utilitzant instruments prims que s’ introdueixen a través dels orificis naturals o a través d’ una petita incisió en un costat. No tots els estadis i graus tumorals poden tractar-se d’aquesta manera; està reservat per a tumors de baix grau, únics, menors de 2cm i que no produeixen obstrucció de la via urinària.
La fulguració làser es pot considerar un tractament curatiu només en situacions concretes, ja que es registren entre 50-70% de recurrències després del procediment, cosa que obligaria a un seguiment molt estret i a repetir cada poc temps l’exploració de la via urinària. El gran avantatge d’aquest procediment és que permet la preservació del ronyó, evitant la seva extirpació. Està indicat en pacients amb tumors urotelials poc agressius en pacients amb un sol ronyó o pacients amb insuficiència renal per evitar la diàlisi.
Cirurgia
Per al tractament de càncer de cèl·lules de transició de pelvis renal i d’urèter s’utilitza un dels següents procediments quirúrgics:
- Nefroureterectomia: cirurgia per extirpar tot el ronyó, l’urèter i el maneguet de la bufeta (teixit que connecta l’urèter amb la bufeta). És indicat en els tumors localitzats que no són susceptibles de maneig endoscòpic amb fulguració làser. També es realitza en la malaltia localment avançada o metastàtica, representant una opció pal·liativa. La cirurgia es completa amb una limfadenectomia regional (extirpació dels ganglis limfàtics de la pelvis).
- Resecció segmentària de l’urèter: procediment quirúrgic per extirpar la part de l’ urèter que conté el càncer i part del teixit sa que l’ envolta. Després, es tornen a unir els extrems de l’urèter. Aquest tractament s’utilitza quan el càncer és superficial i es localitza només al terç inferior de l’urèter, a prop de la bufeta. La realització d’ aquest procediment en altres localitzacions ureterals s’ associa a una taxa alta de recidiva. La cirurgia es completa amb una limfadenectomia regional (extirpació dels ganglis limfàtics de la pelvis).
En qualsevol d’ aquestes tècniques, es pot utilitzar la cirurgia mínimament invasiva, ja sigui la cirurgia laparoscòpica o la cirurgia robòtica. La nefroureterectomia radical laparoscòpica i robòtica han demostrat bons resultats oncològics, així com una menor taxa de sagnat intraoperatori i un millor postoperatori
Quimioteràpia i tractaments inhibidors de “check-point” cel·lular
La quimioteràpia adjuvant (després de la cirurgia) assoleix una taxa sense recidives de fins al 50%, i té un efecte sobre la supervivència. No tots els pacients reben aquest tractament a causa de malalties concomitants i a l’alteració de la funció renal després de la cirurgia radical. L’ esquema de tractament que s’ utilitza està basat en l’ ús del cisplatí, en combinació amb altres quimioteràpics. En els casos en què la malaltia progressi malgrat l’ús de quimioteràpia, o en el cas que la funció renal no sigui bona i, per tant, no es pugui administrar quimioteràpia, es podran utilitzar tractaments basats en tractaments inhibidors de “check-point” cel·lular com són el Pembrolizumab, Atezolizumab i el Nivolumab.
Radioteràpia
L’ús de radioteràpia postoperatòria per a neoplàsies malignes de la pelvis renal continua sent encara motiu de controvèrsia, ja que s’assumeix que aquestes són radioresistents. Hi ha poca evidència sobre el seu ús en tumors de via superior.
Pronòstic
El pronòstic depèn de l’estadi i el grau del tumor. La supervivència a 5 anys per al carcinoma de cèl·lules transicionals és de 50%, però si el tumor és indiferenciat només el 25% dels pacients sobreviuen després de 5 anys. El carcinoma epidermoide té una capacitat inusualment agressiva per estendre’s als ganglis limfàtics regionals, i per això qualsevol tipus de tractament no modifica la seva sobrevida, sent gairebé sempre mortal en el termini d’un any i amb una sobrevida quinquennal inferior al 10%.
A causa del caràcter multicèntric d’ aquests tumors i de la propensió a la recidiva, els pacients s’ han de vigilar acuradament encara després d’ una cirurgia radical.
El diagnòstic precoç i el tractament oportú d’ aquestes neoplàsies són factors fonamentals en el pronòstic d’ aquests pacients.
Seguiment
S’ efectuen cistoscòpia, citologies urinàries i tomografies del tòrax, abdomen i pelvis, cada 3 mesos durant 2 anys, cada sis mesos en els 2 anys següents i després anualment. El motiu de realitzar la cistoscòpia amb tanta assiduïtat és perquè el 30 a 50% de pacients amb carcinoma de cèl·lules transicionals de pelvis renal, poden desenvolupar sincrònicament aquesta neoplàsia a la bufeta.
Per als tumors tractats mitjançant fulguració làser es duen a terme ureterorinescòpies cada 3 mesos durant 2 anys, i després cada 6 mesos, si bé és cert que els protocols poden variar depenent de les troballes operatòries i de l’estat de salut del pacient.
Tumors benignes de la glàndula suprarenal
Les glàndules suprarenals són uns petits òrgans que es localitzen, tal com el seu nom ho indica, per sobre i adjacent a ambdós ronyons. Tenen forma de Y, V o T invertides i pesen aproximadament 5 grams cadascuna. L’escorça suprarenal secreta cortisol, aldosterona i andrògens; la secreta epinefrina i norepinefrina.
Els tumors benignes de la glàndula suprarenal són freqüents, afectant el 9% de la població; però, els càncers són molt infreqüents. La detecció dels tumors ha augmentat significativament amb l’ús cada vegada més freqüent de la tomografia computada (TC) i ressonància magnètica (RM), en les quals moltes d’aquestes lesions són detectades de forma incidental.
Les lesions més comunes són l’adenoma i les metàstasis, sent l’adenoma la patologia més prevalent en els pacients sense antecedent neoplàsic. A més d’ aquests, a nivell suprarenal es poden trobar feocromocitomes, carcinomes, limfomes, mielolipomes, quists i pseudoquistes, hemangiomes i hematomes, entre d’ altres.
Adenomes
Constitueixen una troballa comuna a TC i RM. Són petits, no funcionants, es troben en pacients asimptomàtics i corresponen a una troballa incidental. Una minoria d’adenomes són hiperfuncionants, responsables de trastorns endocrins com les síndromes de Cushing (excés de glucocorticoides) o de Conn (hiperaldosteronisme), en què els adenomes suprarenals representen un 20% i un 80% d’aquests, respectivament. Aquesta lesió es caracteritza histològicament per la presència de cèl·lules clares amb abundant lípid intracitoplasmàtic (greix microscòpica) separat per teixit fibrovascular.
Metàstasi
És la lesió maligna més comuna de les glàndules suprarenals, sent aquest el quart lloc més freqüent de metàstasi al cos, malgrat la mida d’aquestes glàndules. Neoplàsies primàries que metastatitzen freqüentment les glàndules suprarenals provenen de pulmó, mama, ronyó, intestí i pàncrees. El melanoma és un tumor poc freqüent, que també metastatitza aquests òrgans. Les metàstasis són freqüentment bilaterals, de major grandària que els adenomes, heterogènies i de condorns irregulars en les proves d’ imatge.
Feocromocitoma
És un tumor rar, secretor de catecolamines, originat del teixit neuroectodèrmic de la suprarenal. Els símptomes derivats d’aquest tumor són secundaris a l’excés d’epinefrina i norepinefrina; entre aquests s’inclouen la hipertensió arterial episòdica, cefalea, ansietat i palpitacions.
Ha estat anomenat el tumor dels 10%s: 10% bilaterals, 10% extraarenals, 10% malignes, 10% en nens, 10% associat a síndromes, com neoplàsies endocrines múltiples NA i III, síndrome de Von Hippel Lindau i neurofibromatosi. El diagnòstic és clínic i de laboratori (elevació de catecolamines plasmàtiques i urinàries) i d’altra banda a través de proves complementàries, ja sigui per TC o RM, que presenten un rendiment similar en la detecció d’aquests tumors en les glàndules suprarenals.
Els feocromocitomes en general mesuren entre 2 i 5 cm, són hipervasculars i presenten abundant líquid, molts d’ ells amb àrees quístiques al seu interior. Quan es localitzen en situació extraadrenal es denominen paragangliomes i s’ han de buscar cabal a l’ origen de l’ artèria mesentèrica inferior o adjacent a la bifurcació aòrtica.
La cirurgia radical és l’únic tractament que pot portar a la remissió completa.
Mielolipoma
Tumor benigne poc freqüent, compost per teixit adipós madur i hematopoètic. La majoria són descoberts de forma incidental; en ocasions poden sagnar.
Limfoma
El compromís per aquesta malaltia és poc freqüent, sent en la majoria dels casos del tipus no-Hodgkin. Dels pacients amb limfoma no-Hodgkin, el 4% presenten compromís suprarenal.
Lesions quístiques
Són poc comuns, i es va demostrar en el 0,1% de les autòpsies. Usualment són asimptomàtiques, i ocorren preferentment entre la tercera i cinquena dècada de la vida. Poden associar-se a dolor o massa palpable quan són molt grans. Es divideixen en quatre subtipus: quists revestits d’endoteli (40%), pseudoquistes posthemorràgia (39%), quists parasitaris, quists revestits d’epiteli.
Hematomes
Ocorren en relació a trauma, en especial quan hi ha compromís del lòbul hepàtic dret i compressió directa de la glàndula suprarenal ipsilateral contra la columna. També poden ser visualitzats en el context de trombosi de vena suprarenal, hipotensió i xoc.
Tractament quirúrgic dels tumors benignes de la glàndula suprarenal
La cirurgia laparoscòpia en els adenomes suprarenals, va ser la primera cirurgia laparoscòpica que va demostrar els avantatges actuals de la cirurgia mínimament invasiva. La cirurgia laparoscòpica, la cirurgia per retroperitoneoscòpia i la cirurgia robòtica de la glàndula suprarenal ha demostrat un menor sagnat operatori, menor temps operatòria, millor recuperació postoperatòria, menor estada hospitalària i menor temps fins a la recuperació de l’ activitat laboral, per la qual cosa actualment es consideren les tècniques d’ elecció per a la realització de cirurgia suprarenal.
Tumor maligne de la glàndula suprarenal (carcinoma suprarenal)
Tumor rar (0,02% de tots els càncers, amb incidència global entre el 0,5-2/1.000.000 habitants), originat de l’escorça suprarenal, en general entre la quarta i setena dècades de la vida. Afecta tots dos sexes, amb una discreta preponderància femenina, especialment cap al final de la tercera i quarta dècades, tot i que pot presentar-se en edats extremes. És hiperfuncionant en un 20-40% dels casos, manifestant-se més comunament com a síndrome de Cushing. Es pot presentar amb dolor abdominal i massa palpable.
Al diagnòstic, el tumor és gran, en general major a 6 cm, assolint en alguns casos fins a 20 cm. Es pot observar invasió directa d’ òrgans veïns, de la vena renal i vena cava inferior. Aproximadament el 50-60% dels casos presenten clara evidència de disseminació locorregional o a distància en el moment del diagnòstic.
L’etiologia és desconeguda, no havent-se identificat factors predisponents; no obstant això, se sap que les cèl·lules tumorals despleguen diverses fallades enzimàtiques en els sistemes de la gènesi d’esteroides (11-beta-hidroxilasa, 17-alfa-hidroxilasa, 21-hidroxilasa, 3-beta-hidroxiesteroide-deshidrogenasa i delta5-delta4-isomerasa). Per tant, se suposa que l’ origen tumoral pren lloc en algun punt d’ aquesta fallada enzimàtica. A més, s’ha demostrat una pèrdua d’al·lels en els cromosomes 11p, 13q i 17p de carcinomes no presents en casos d’adenomes o hiperplàsies.
Els tumors adrenals són més freqüents dins de l’espectre de diverses síndromes genètiques, com la síndrome de Gardner, el de Li-Fraumeni i el de Beckwith-Wiedemann. Així mateix, el 52% dels tumors mostren positivitat immunohistoquímica per al gen p53, 80% per al gen del retinoblastoma (RB), 22% per al gen del neuroblastoma, i 20% per al gen del von Hippel Lindau.
Símptomes
El tumor es palpa com una massa abdominal en el 30-40% dels pacients a conseqüència del seu lent creixement. Depenent de la mida i localització pot produir símptomes gastrointestinals com sacietat precoç, sensació de distensió, nàusees i vòmits. Astènia, fatiga, pèrdua de pes i febrícula són símptomes freqüents, igual que el dolor abdominal. La tendència a envair les estructures vasculars és la causa que s’originin símptomes atípics secundaris a trombosi de cava inferior (edemes perifèrics), vena renal (hematúria i proteinúria) o tronc portal (hipertensió portal amb hepatoesplenomegalia).
Els tumors funcionants poden produir substàncies que causen símptomes molt diversos. En l’home, els símptomes s’engloben en una síndrome clínica anomenada hiperandrogenisme (augment de gruix del pèl, calvicie temporal, acné). En el cas de la dona, el 75% d’aquests tumors es manifesta en forma de virilització (hirsutisme, amenorrea, hipertròfia del clítoris, aparició de barba, entrades temporals i calvicie). Aquests símptomes estan mitjans per la secreció de l’hormona DHEA-S. En tots dos sexes es pot donar l’hipercortisolisme, desenvolupant-se una síndrome de Cushing (cara de lluna plena, morrió de búfal, plètora, equimosi, hipertensió i hipopotasèmia amb igual freqüència, avançament cutani, estries i hipertròfia ventricular esquerra). En nens, es manifesta amb pubertat precoç. Menys freqüentment poden aparèixer símptomes deguts a la hipersecreció de mineralocorticoides, insulina, eritropoyetina, vasopresina, estrògens i hormona del creixement.
Metàstasi: en termes de disseminació a distància, el carcinoma suprarenal metastatitza en el pulmó (60%), fetge (50%), limfàtics (48%), os (24%), pleura i cor (1%), sent molt poc freqüent la metastatització a ronyó (5%) i cervell (4%).
Classificació clincidico histològica
Pot ser dividit en:
- Variant diferenciada, composta per cèl·lules que s’assemblen a les normals, disposades de forma organitzada.
- Variant indiferenciada o pleomòrfica, composta per cèl·lules amb nuclis bèsties, desordenades, amb falta de cohesió entre si.
Diagnòstic
Davant la sospita d’un carcinoma adrenal, la seqüència diagnòstica s’encamina a demostrar el grau de funció, a identificar el grau d’invasió local i a descartar la presència de metàstasi.
Estudi radiològic
La primera tècnica d’ imatge a utilitzar en el pacient en qui se sospita un carcinoma adrenal és el TAC o RM, seguida de la gammagrafia amb I-colesterol que aporta una informació addicional sobre la naturalesa funcional. La tomografia d’emissió de positrons (PET) amb desoxiglucosa o fludesoxiglucosa-F-18 ha demostrat ser un magnífic mètode per diagnosticar les masses adrenals en pacients amb carcinomes coneguts.
Estudi hormonal
A més de les proves radiològiques s’utilitzen estudis funcionals, en els quals s’intenta detectar residus metabòlics de les substàncies que produeix el propi tumor, a causa de les seves pròpies fallades enzimàtiques (els més freqüents són el de
l’11-beta-hidroxilasa i el de la 3-beta-hidroxiesteroide-deshidrogenasa). Aquest estudi s’ anomena anàlisi cromatogràfica dels diferents esteroides. Les alteracions trobades són:
- Els produïts per la síndrome de Cushing: marcada eliminació de cortisol en sang i orina
- Els produïts per l’ hiperandrogenisme: marcada eliminació de 17-cets i d’ 11-desoxicortisol en orina. Augment de DHEA-S plasmàtica. La DHEA-S és el millor marcador del carcinoma i les seves concentracions plasmàtiques romanen elevades i no suprimides a valors normals després de la supressió amb 2 mg de dexametasona/dia durant 5 dies.
- Els produïts per la feminització / pubertat precoç: elevació d’estradiol, estrona i/o estriol; eliminació urinària augmentada de 17-17 en orina.
- Els produïts per l’ansteronisme: elevació de precursors com la DOCA i la 18-hidroxicorticosterona. A més, apareix hipopotasèmia. És típica la manca de resposta a la infusió d’ACTH. Així mateix, els carcinomes no mostren el clàssic descens d’aldosterona pels canvis posturals.
Estadificació
La malaltia es pot classificar, depenent de la seva extensió, en:
- Malaltia localitzada: tumor que després de la seva extirpació està confinat a l’adrenal no podent-se posar de manifest l’existència de metàstasi. Menys del 5% dels carcinomes adrenals es troben en aquesta categoria.
- Malaltia regional: tumor amb afectació del/s teixits contigus i dels òrgans de veïnatge, incloent-hi els ganglis limfàtics, però sense evidència de metàstasi a distància. Entre el 20-30% dels tumors s’ inclouen en aquest grup.
- Malaltia a distància: tumors metastatitzats en el moment del diagnòstic. En aquest grup s’ inclouen el 40-60% dels tumors.
- Malaltia recurrent: aparició de recidiva local o disseminació a distància després de la resecció teòricament curativa del tumor primari.
Segons l’ estadi, es pot classificar en:
- Estadi I: (T1N0M0). Tumor menor de 5 cm sense ganglis, sense invasió local i sense metàstasi.
- Estadi II: (T2N0M0). Tumor major de 5 cm sense ganglis, sense invasió local i sense metàstasi.
- Estadi III: (T1 o T2N1M0 o T3N0M0). Qualsevol mida, amb ganglis o invasió local, sense metàstasi.
- Estadi IV: (qualsevol T, qualsevol NM1 o T3-T4N1). Qualsevol mida, amb ganglis o invasió local, amb metàstasi.
Pronòstic i evolució
El pronòstic depèn de diverses característiques histològiques que desplega el tumor: presència de zones extenses de necrosi, bandes de fibrosi, invasió capsular, invasió vascular, arquitectura del tumor (organitzat o difús), proporció de cèl·lules clares, pleomorfisme nuclear, activitat mitòtica i presència de mitosis atípiques.
En general el pronòstic és molt dolent, amb una mortalitat entre el 65-94% als 5 anys, una supervivència mitjana de 29 mesos i una supervivència mitjana del 35% a 5 anys. Per estadis, la supervivència actuarial a 5 anys pot xifrar-se en un %-46% per als estadis I-II, en un 43-21% per al III i en un 4-6% per a l’estadi IV.
Tractament
Tot i que el carcinoma adrenal és un tumor d’alt grau de malignitat i una curta expectativa de vida, s’ha d’intentar un tractament que almenys permeti un temps acceptable de remissió, i en els casos de tumor funcionant, un millor control dels símptomes.
Cirurgia
La cirurgia, amb visos curatius o pal·liatius, està indicada en els casos de tumors amb malaltia local o regional, mentre que en els pacients amb tumors disseminats pot ser discutible la indicació de cirurgia pal·liativa de citorreducció, podent ser novament electiva en els casos de metàstasi úniques aïllades en òrgans assequibles i en els casos d’algunes recidives locals. En altres ocasions, la cirurgia de citorreducció està indicada per facilitar l’acció dels fàrmacs adrenolítics o de quimioteràpia.
La via d’ abordatge és oberta en casos d’ afectació o sospita d’ afectació d’ òrgans veïns. La laparoscòpia queda, en aquest cas, reservada per a lesions localitzades dins de la glàndula. En un alt percentatge dels casos cal realitzar una nefrectomia en bloc. A més, es realitza una limfadenectomia regional, que compleix amb un propòsit doble: oncològic i d’ estadificació.
En casos seleccionats amb invasió de la vena cava pot estar indicada la trombectomia o la resecció de la cava infrarrenal, si bé els resultats són tan desesperançadors que no sembla ser una maniobra rutinàriament aconsellable.
Tractament adrenolític
El tractament postoperatori amb alguns fàrmacs d’ acció adrenolítica pot millorar i prolongar la supervivència quan s’ instaura immediatament després de la cirurgia, tot i que no se sap si aquest tractament pot prevenir l’ aparició de les recidives locals.
El fàrmac d’elecció és el mitotane o Lysodren (a dosis d’1-2 g/dia fins a arribar a 5-6 g/dia), utilitzat per al tractament de la malaltia metastàtica. Aquest medicament millora els símptomes deguts a l’hipercortisolisme doncs, en bloquejar l’11-beta-hidroxilasa, redueix dràsticament la síntesi de cortisol. A més, ajuda a reduir la possible aparició de recidives locals i és ara per ara l’única alternativa possible en la malaltia amb extensa disseminació a distància. Els estudis realitzats amb aquest fàrmac han confirmat remissions mesurables del tumor de 34-60% i augment de supervivència global d’un 20-25%. De tota manera, el grau de resposta clínica no supera el 25%. Els efectes secundaris del mitotane són: nàusees (88%), vòmits (23%), diarrea (38%), debilitat, dermatitis (23%), ginecomastia (50%), artràlgies (19%), leucocènia (7%), hipercolesterolèmia, hepatotoxicitat, símptomes neurotòxics (pèrdua de memòria i capacitat de concentració en un 50%, somnolència i vertigen) i prolongació del temps d’hemorràgia per un efecte semblant al de l’aspirina. La resposta, en cas de produir-se, té una durada mitjana de 6-10 mesos.
Quimioteràpia
El carcinoma cortical és molt poc sensible als fàrmacs de quimioteràpia i s’ha afirmat que és un tumor intrínsecament resistent a la quimioteràpia.
Radioteràpia
La radioteràpia té només un paper pal·liatiu, especialment en les metàstasis òssies doloroses.
Carcinomes adrenals en nens
En nens, igual que en l’adult, els càncers adornals solen ser tumors majors de 4 cm, amb una preponderància masculina de 2/1 i una edat mitjana de presentació d’uns 5 anys. La forma més freqüent de presentació és l’hirsutisme (50%) i la virilització (76%), síndrome de Cushing (30%) i feminització (10%), tumoració no funcionant (8%) o molt rarament associat amb una síndrome de pèrdua salina per hiperplàsia adrenal congènita. No són infreqüents les associacions amb malformacions d’altres òrgans, com l’hemihipertròfia, síndrome de Beckwith-Wiedemann, malformacions vasculars, urològiques o tumors cerebrals. El 57% tenen tumor palpable, el 80% malaltia local, el 7% malaltia locorregional i el 13% metàstasi a distància en el moment del diagnòstic. Com en l’adult, la supervivència mitjana és del 50% aproximadament als 5 anys.
Patología de l’uraco
L’uraco o lligament umbilical mitjà és una estructura de la línia mitjana que s’ estén des de la cara anterior de la bufeta cap a l’ ombligo. És un romanent del desenvolupament embrionari que prové de l’alantoides (sac vitelí). El normal és que s’obliti per a les 15 setmanes de gestació, i sigui ja un cordó fibrós per a les 20 setmanes.
La persistència de l’uraco pot originar diversos problemes clínics, no només en nens, també en adults. Les malalties que l’afecten són poc comunes (1 de cada 5.000 persones) i la seva manifestació abdominal, símptomes o signes urinaris són inespecífics, per la qual cosa el seu diagnòstic no sempre resulta fàcil.
La tríada clàssica de presentació de la patologia de l’ uraco és:
- Reordenació a través de l’ ombligo.
- Dolor abdominal.
- Símptomes urinaris.
Depenent del mode de presentació, la patologia de l’ uraco pot ser:
- Uraco persistent. Quan el cordó fibrós que s’estén des de l’ombligo fins a la cúpula vesical segueix permeable (obert). Pot contenir àrees estretes, anfractuoses o dilatades. És més comú en homes que en dones, amb una relació 2:1. L’ uraco persistent pot estar associat a anomalies congènites del tracte urinari inferior, com valves uretrals posteriors o atresia ureteral completa. Poden complicar-se amb infeccions i, en casos molt rars, amb càncer. Lamentablement el càncer uracal és de pronòstic dolent, ja que en el moment del diagnòstic generalment presenten invasió local.
- Diverticle uracal. Es desenvolupa quan la porció supra-vesical de l’ uraco no es tanca i és generalment asimptomàtica. En les proves d’ imatge apareix com una sortint de perfil d’ aspecte quístic, en la línia mitjana. Es complica amb infeccions del tracte urinari, formació de càlculs intrauracals i té relació amb un augment de la prevalença de carcinoma.
- Si uracal. Es produeix quan la porció més dilatada de l’urac persistent és la que està més a prop de l’ombligo, continuant amb tractes anfractuosos quan es va acostant a la bufeta. Pot manifestar-se amb secrecions fètides a través de l’ ombligo, cel·lulitis, escozor o dolor a la paret de l’ abdomen i formació de qualificacions dins del si.
- El quist uracal. Es desenvolupa quan l’ uraco s’ oblitera en els extrems vesical i umbilical, restant entre aquests punts una porció permeable que acumula secrecions, prenent un aspecte quístic. Generalment això passa al terç inferior. La seva mida és variable, però generalment són petits. Quan es fan simptomàtics augmenta la seva mida amb reforç de la seva paret. El seu diagnòstic pot ser mitjançant ultrasò o tomografia computada, en la qual es manifesta com una cavitat plena de líquid en la línia mitjana de la paret abdominal baixa. Així com en altres anomalies uracals, la infecció és la complicació més comuna.
Diagnòstic
El diagnòstic es realitza mitjançant examen físic, palpant l’ abdomen i detectant la presència del tracte dilatat sota la pell o de calcificacions en el trajecte uracal. De vegades, això no resulta senzill, i menys en pacients obesos.
Les proves d’ imatge que comunament es realitzen inclouen l’ ecografia, la tomografia i la ressonància magnètica. Són eines molt útils, perquè permeten diagnosticar el tipus de patologia uracal i la possibilitat que hi hagi malignitat associada.
La cistoscòpia també assisteix en el diagnòstic, ja que permet a l’explorador observar directament la comunicació de l’urac persistent amb la cúpula de la bufeta.
Tractament
Als pacients que se’ls diagnostica una infecció d’un si, diverticle o quist d’urac, se’ls indica antibiòtics amb pautes prolongades i lavabo local.
La gran majoria de les vegades el tractament definitiu és quirúrgic. La cirurgia pot ser laparoscòpica o oberta, i inclou l’exèresi de tot el cordó uracal, de la cúpula vesical i, de vegades, l’ombligo.
- SUPRARRENALECTOMIA
- NEFRECTOMIA RADICAL LAPAROSCÒPICA
- NEFRECTOMIA PARCIAL LAPAROSCÒPICA
- NEFRECTOMIA PARCIAL ROBÒTICA
- NEFROURETERECTOMIA LAPAROSCÒPICA
- NEFROURETERECTOMIA ROBÒTICA
- RESECCIÓ TRANSURETRAL DE BUFETA
- CISTECTOMIA RADICAL LAPAROSCÒPICA
- CISTECTOMIA RADICAL OBERTA
- CISISTECTOMIA RADICAL ROBÒTICA
- RECONSTRUCCIÓ DE LA VIA URINÀRIA (DERIVACIÓ O NEOVEJIGA).
- URETEROILEOSTOMIA TIPUS BRICKER.
- NEOVEJIGA ILEAL
- PROSTATECTOMIA RADICAL LAPAROSCÒPICA
- PROSTATECTOMIA RADICAL ROBÒTICA
- PRESERVACIÓ DE BANDELETES NEUROVASCULATRES
- LINFADENECTOMIA INGUINAL / PÈLVICA / RETROPERITONEAL LAPAROSCÒPICA/ROBÒTICA
- URETRECTOMIA
- PENECTOMIA PARCIAL
- PENECTOMIA TOTAL
- PENECTOMIA RADICAL
- ORQUIECTOMIA INGUINAL